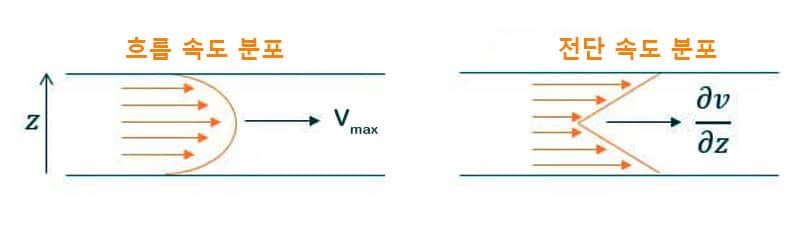왜 세포 생물학에서 전단 응력을 제어해야 할까요?
세포 생물학에서 전단 응력은 이중적인 역할을 수행합니다. 한편으로는 체외(in vitro)에서 세포와 오가노이드를 다룰 때 세포 손상을 방지하기 위해 최소화되어야 합니다. 반면, 생체 내(in vivo)에서는 혈관의 내피 세포나 신장, 장, 간의 상피 세포 등 많은 세포들이 혈류로 인한 전단 조건에 지속적으로 노출되며, 이는 건강한 세포 조직과 유전자 발현에 필수적입니다. 따라서 체외 실험 및 오간 모델링 실험에서는 전단 응력을 정확하게 측정하고 재현하는 것이 중요합니다.
전단 응력 물리적 정의
전단 응력은 표면에 접선 방향으로 작용하는 힘입니다. 유체의 전단 응력은 유체의 속도와 점성도에 따라 달라집니다. 따라서 뉴턴 유체의 경우 간단히 다음과 같은 식으로 표현할 수 있습니다:
τ = η * (∂v/∂z)
여기서 η는 점성도(Poise, g/cm·s), ∂v/∂z는 속도 기울기 또는 전단 속도(s⁻¹)입니다.
미세유체 채널에서 층류가 흐를 경우 속도 분포는 포물선 형태를 띱니다. 중심부에서 속도가 가장 빠르고, 채널 벽면에서는 가장 느립니다. 결과적으로 전단 응력은 벽면에서 가장 크고, 채널 중심에서는 가장 작습니다(그림 1).
실험 조건에 맞는 전단 응력을 계산하려면 저희 전단 응력 계산기를 사용해 보세요. 시스템에 적용할 유속 또는 압력, 미세유체 칩 및 튜빙의 치수를 입력하면 세포 배양에 적합한 전단 응력을 정확하게 제어할 수 있습니다.
세포에 미치는 전단 응력의 영향
일반적인 체외 실험에서 세포는 배지 흐름이 없는 페트리디쉬에 배양됩니다. 이는 세포의 실제 행동을 충분히 반영하지 못하는 불완전한 모델입니다. 살아있는 생물체에서는 세포들이 유체의 움직임으로 인해 지속적으로 전단 응력을 받습니다. 따라서 체외 시스템에 전단 응력을 도입하는 것은 다음과 같은 이유로 필수적입니다:
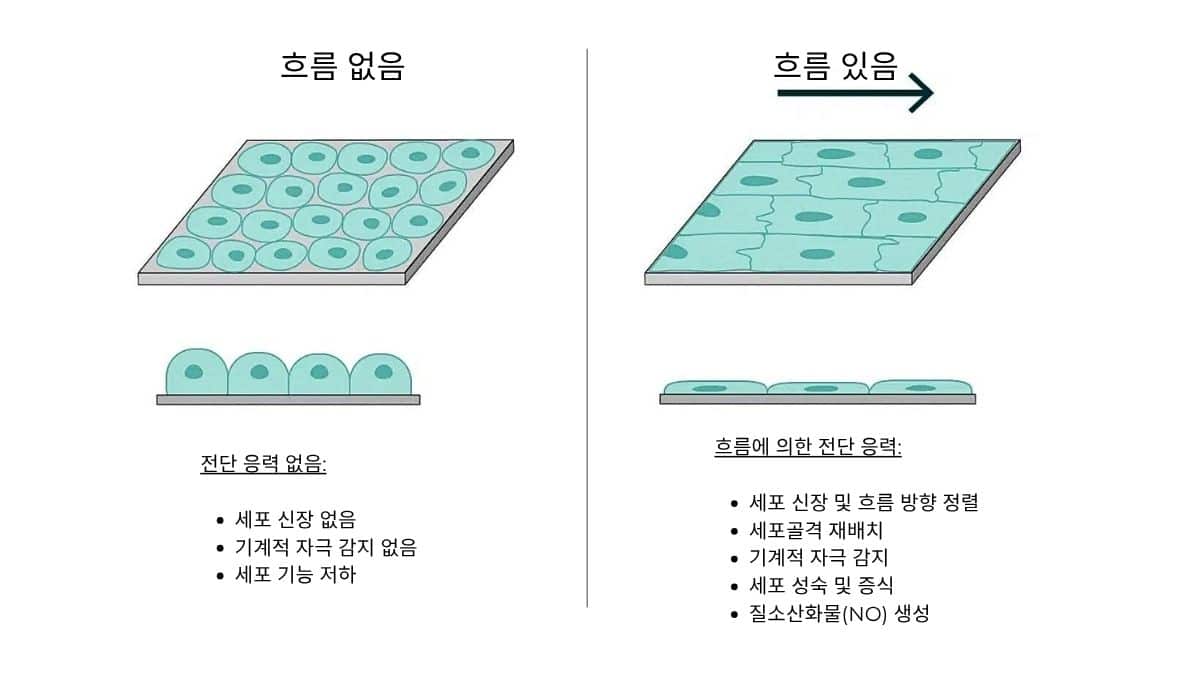
- 기계적 자극: 유체 흐름은 세포에 기계적 자극을 제공하여 특히 내피 세포 및 다른 부착 세포 배양에서 유체 방향으로 세포가 길어지게 합니다(그림 2).
- 내피 세포 반응: 내피 세포는 전단 응력에 매우 민감하게 반응하며, 세포골격 재구성이 일어납니다[2]. 이러한 반응은 혈관의 항상성 유지와 혈관신생 및 혈관 재형성과 같은 과정에 영향을 미칩니다[3].
- 암세포 역학: 암 연구에서 전단 응력은 전이 과정인 혈관외 이행 및 간질 이동과 같은 과정에 기여하는 것으로 알려져 있습니다. 정적 조건에서는 약 9.4 μm/h이던 종양 세포의 평균 혈관 내 이동 속도가 혈류 조건에서는 약 12.5 μm/h로 증가하는 것이 관찰되었습니다[4].
- 생리적 관련성 및 정확성 향상: 층류 조건에서 배양된 HUVEC(인체 제대 정맥 내피 세포)는 궤도 진탕 배양 조건보다 조직 인자 발현이 더 생리적으로 유사한 것으로 나타났습니다[5].
- 기관 특이적 전단 응력: 다양한 조직은 서로 다른 생리적 전단 응력 수준에 노출됩니다. 따라서 체외 실험을 설계하거나 모델링할 때 이 점을 반드시 고려해야 합니다.
| 세포 유형 | 전단 응력 값 (Pa) | 전단 응력 값 (dyn/cm²) |
|---|---|---|
| 동맥 [6] | 1-2 | 10-20 |
| 정맥[6] | 0.1 -0.6 | 1-6 |
| 小쥐 배아 신장 [7] | 0.04 – 0.5 | 0.4 – 5 |
| 인간 신장 [8] | 0.03 -0.12 | 0.3 -1.2 |
| 폐포 상피 세포 [9] | 0.4 -1.5 | 4 -15 |
*더 많은 값은 전문가 리뷰 전문 다운로드를 참조하세요.
세포 미세생리 시스템에서 전단 응력을 제어하는 방법
미세유체 기술의 발전으로 인해 유속과 미세채널 형상의 정밀한 제어가 가능해졌고, 이를 통해 세포에 가해지는 전단 응력을 세밀하게 조절할 수 있게 되었습니다. 초기 연구에서는 특정 수준의 전단 응력이 내피 세포의 구조와 기능에 영향을 미친다는 것이 입증되었습니다[10].
지난 20년 동안 미세유체 기술의 발전은 이러한 효과에 대한 이해를 심화시켰습니다. 최근에는 미세유체 칩 내에서 기능적 조직을 배양하는 오간-온-칩 모델의 개발을 통해, 제어된 기계적 자극이 세포 행동 조절과 감염인자 및 약물 반응 조절에 필수적임이 입증되고 있습니다[11].
전단 응력 제어의 주요 변수
- 기판의 경도 및 탄성: 미세유체 칩 기판의 기계적 특성은 세포가 전단응력을 인식하는 방식에 영향을 줍니다.
- 정밀한 유량 제어: 장기간 동안 안정적이고 재현 가능한 유량을 유지하여 일관된 전단 응력 노출을 보장합니다.
- 미세채널 구조: 미세채널의 모양, 너비, 높이는 세포에 작용하는 전단 응력 분포에 직접적인 영향을 미칩니다.
- 유체 점성도: 배지의 점성도는 전단 응력에 영향을 줍니다. BSA 농도, 첨가제, 온도 변화가 배지 점성도에 영향을 줄 수 있습니다.
- 맥동 유동 vs. 일정 유동: 생리적 조건을 모방하기 위해서는 맥동 또는 진동 유동과 같은 동적 유동 패턴이 필요합니다.
- 세포 밀도 및 부착: 세포의 밀도와 부착 상태는 전단 응력에 대한 반응에 영향을 미칩니다. 최적화된 seeding 조건은 균일한 노출을 보장합니다.
왜 Fluigent와 협력해야 하나요?
Fluigent는 복잡한 과정을 단순화하는 도구들을 통해 오간-온어-칩(Organ-on-a-chip) 연구를 혁신하고 있습니다.
Fluigent의 압력 기반 펌프는 유량 모니터링 및 제어 기능과 결합되어, 마이크로유체 환경에서 세포나 조직에 가해지는 전단응력을 정밀하게 제어할 수 있습니다.
사용자만의 맞춤형 칩을 제작하든, 상용 칩을 활용하든,
Fluigent와 함께 재현 가능하고 생리적으로 의미 있는 결과를 달성해 보세요.
Related ressources
참고문헌
[1] Helmke B.P, Rosen A.B & Davies P.F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys J (2003). doi: 10.1016/S0006-3495(03)75074-7
[2] Malek A.M & Izumo S. Mechanism of endothelial cell shape change and cytoskeletal remodeling in response to fluid shear stress. J Cell Sci (1996). doi: 10.1242/jcs.109.4.713
[3] Campinho P, Vilfan A, Vermot J. Blood flow forces in shaping the vascular system: a focus on endothelial cell behavior. Front Physiol (2020) doi: 10.3389/fphys.2020.00552
[4] Hajal, C., et al. The effects of luminal and trans-endothelial fluid flows on the extravasation and tissue invasion of tumor cells in a 3D in vitro microvascular platform. Biomaterials (2021). doi: 10.1016/j. biomaterials.2020.120470
[5] Rochier A., et al. Laminar shear, but not orbital shear, has a synergistic effect with thrombin stimulation on tissue factor expression in human umbilical vein endothelial cells. J Vasc Surg (2011). doi: 10.1016/j.jvs.2011.01.002
[6] Lipowsky H.H., et al. The distribution of blood rheological parameters in the microvasculature of cat mesentery. Circ Res. (1978). doi: 10.1161/01.res.43.5.738
[7] Kimura H., et al. Effect of fluid shear stress on in vitro cultured ureteric bud cells. Biomicrofluidics (2018). doi: 10.1063/1.5035328.
[8] Ross E.J., et al. Three dimensional modeling of biologically relevant fluid shear stress in human renal tubule cells mimics in vivo transcriptional profiles. Sci Rep (2021). doi: 10.1038/s41598-021-93570-5
[9] Flitney E.W., et al. Insights into the mechanical properties of epithelial cells: the effects of shear stress on the assembly and remodeling of keratin intermediate filaments. FASEB J (2009). doi: 10.1096/ fj.08-124453
[10] Dewey C.F Jr. et al. The dynamic response of vascular endothelial cells to fluid shear stress. J Biomech Eng (1981). doi: 10.1115/1.3138276.
[11] Thompson et al. Mechanical Stimulation: A Crucial Element of Organ-on-Chip Models. Frontiers in Bioengineering and Biotechnology (2020). doi: 10.3389/fbioe.2020.602646