오간온어칩 연구에서의 압력 제어 마이크로유체 기술
오간온어칩(Organ-on-a-Chip, OOC) 기술은 생의학 연구 및 제약 개발 분야를 혁신적으로 변화시키고 있다. OOC 모델의 핵심 특징 중 하나는 유체의 제어된 관류 또는 순환을 가능하게 하는 것이다. 이를 통해 장기의 미세환경을 동적이고 생리학적으로 유사하게 모사할 수 있다. 다양한 유동 제어 방법들 가운데, 압력 제어 마이크로유체 기술은 유속의 안정성과 전단 응력 제어 능력 덕분에 OOC 실험에서 특히 두각을 나타내고 있다. 본 리뷰에서는 Fluigent 사의 솔루션을 활용한 OOC 모델에 적용되는 다양한 마이크로유체 유동 제어 시스템들을 살펴본다.
오간온어칩 실험을 위한 마이크로유체 유동 제어기
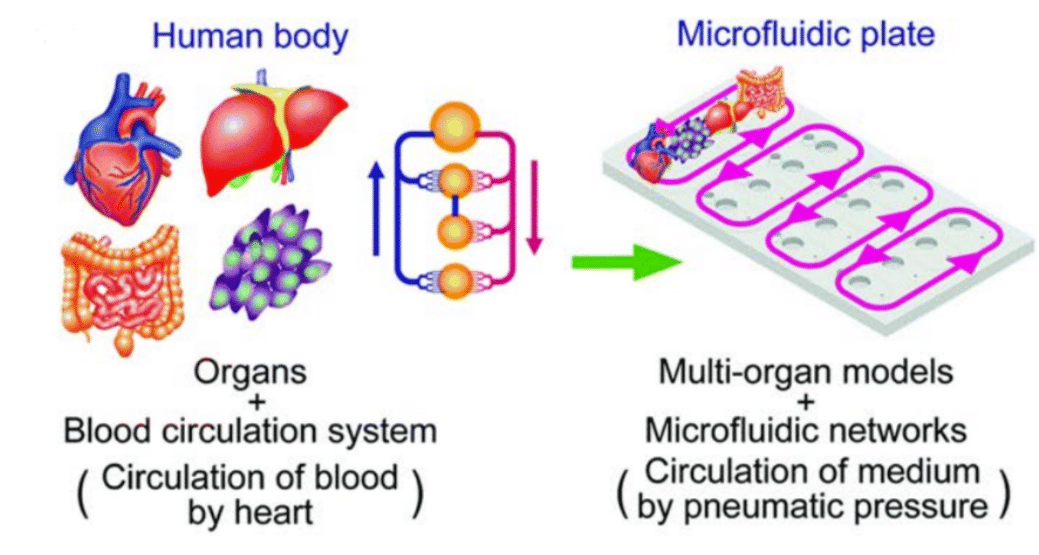
오간온어칩(Organ-on-a-Chip, OOC)는 미세 규모의 장치를 이용해 인체 장기의 구조와 기능을 모사하는 데 사용된다[1]. 일반적으로 OOC 장치는 특정 장기의 반응을 정밀하게 재현하도록 설계된 마이크로유체 채널 내에 세포 또는 장기유사체(organoids)를 포함하고 있다.
장기의 미세환경과 세포 간 상호작용을 재현함으로써, OOC 기술은 전통적인 2차원 세포 배양이나 동물 모델에 비해 장기 기능, 질병 메커니즘 및 약물 반응을 연구하는 데 있어 훨씬 생리학적으로 유의미한 모델을 제공한다.
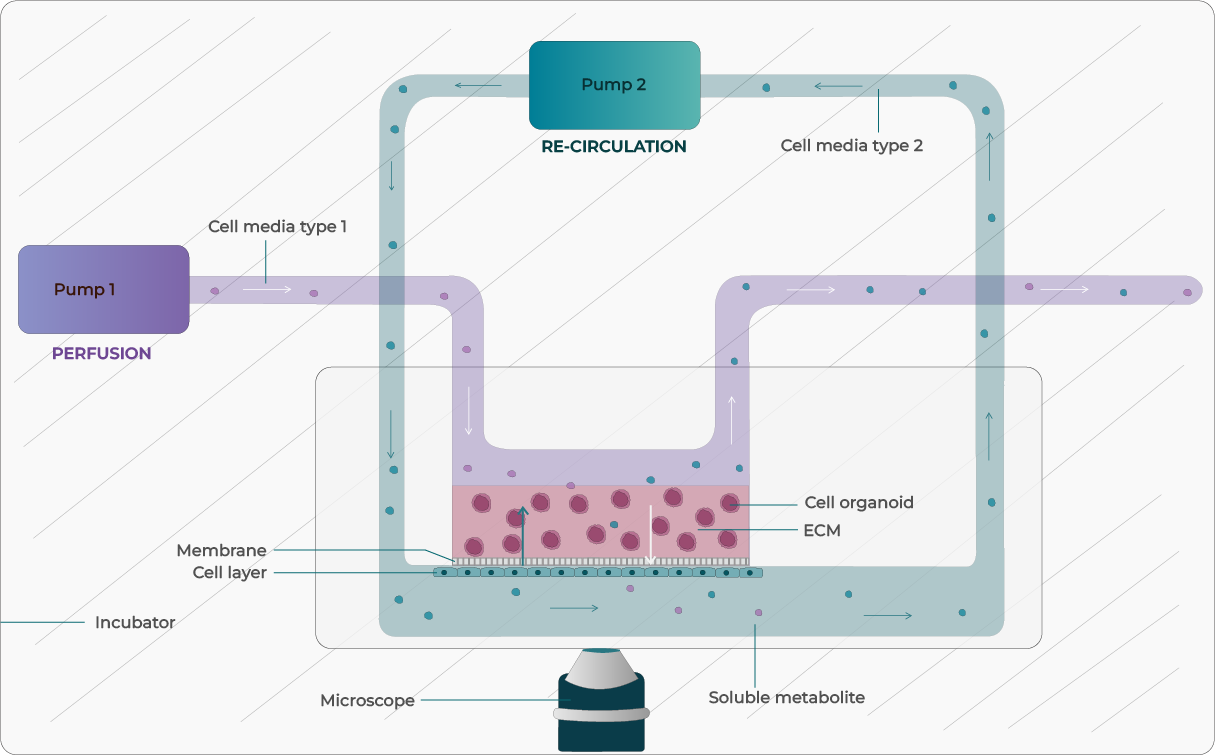
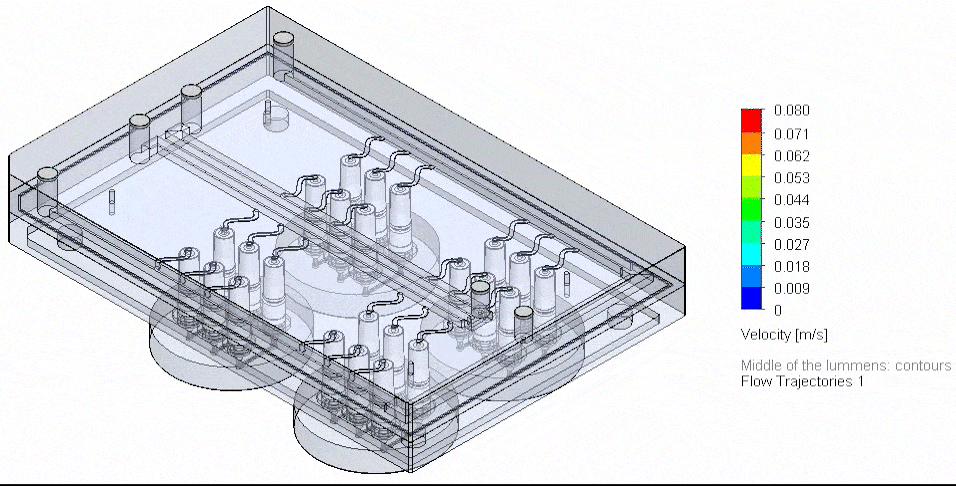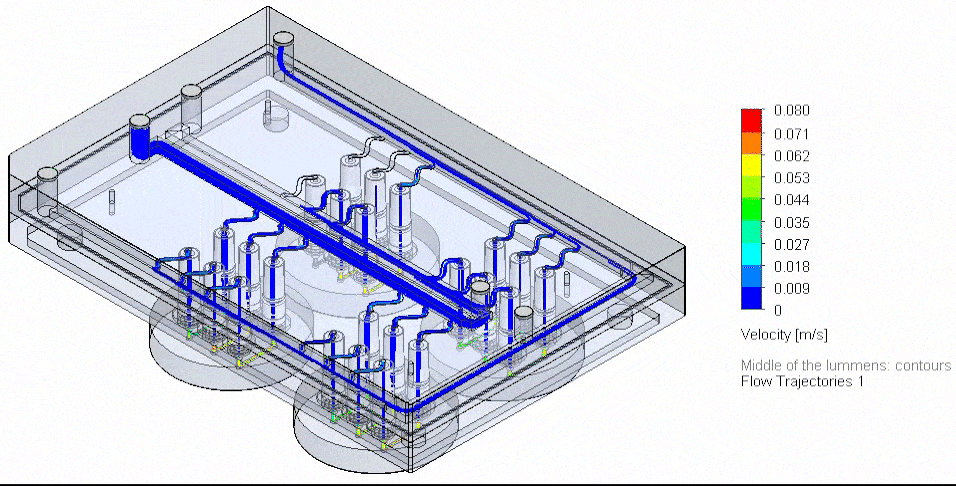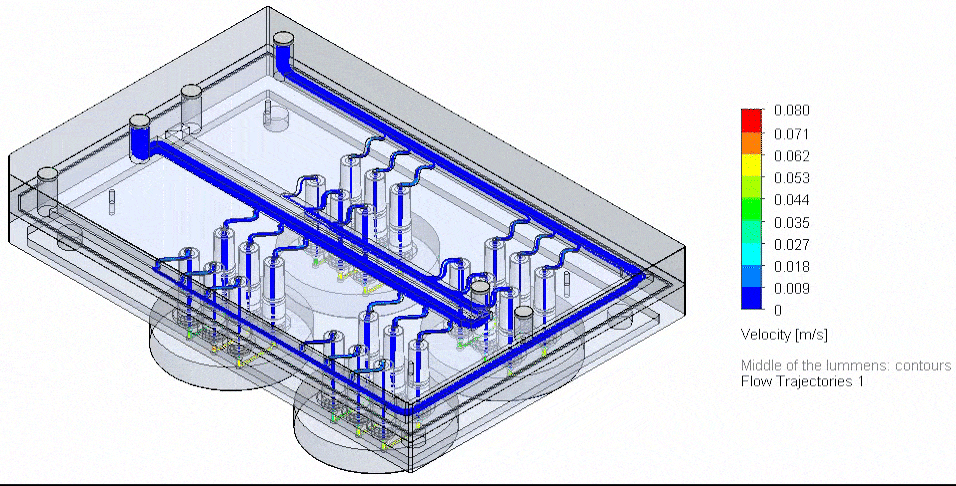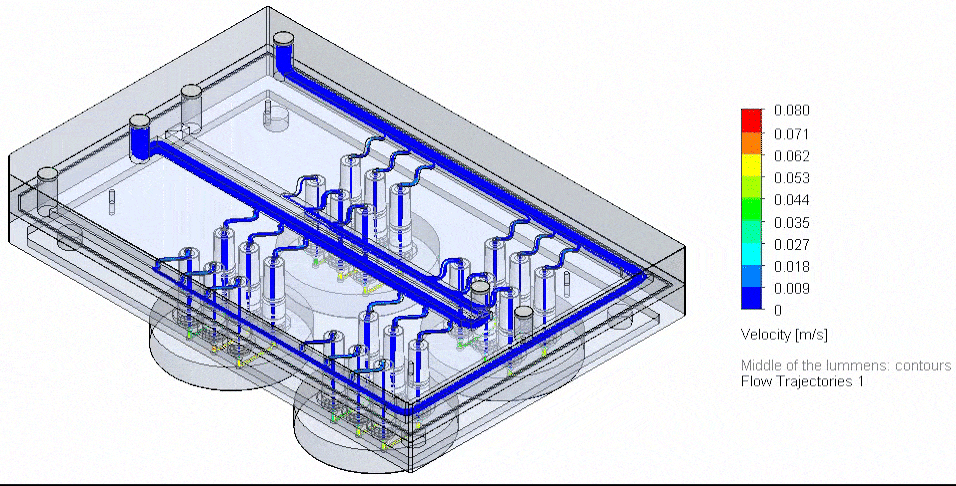
그림 1: 배지 관류 및 순환 시스템이 통합된 OOC 장치의 개념도
OOC 장치에서 생리학적 미세환경을 정확하게 재현하는 데 핵심적인 요소 중 하나는 영양분을 공급하고 약물, 대사산물, 전사 조절 인자 등을 수송하기 위한 정밀한 액체 관류 시스템이다. 연구자들은 다양한 유동 제어 기술을 활용할 수 있으며, 각각의 기술은 고유한 장점과 한계를 가지고 있다(표 1).
1. Peristaltic pumps
Peristaltic pumps는 유연한 튜브를 압착하여 액체를 밀어내는 양압식 작동 원리를 사용해 튜브 내에서 맥동 흐름(pulsatile flow)을 생성한다. 생물학 분야에서 널리 쓰이며, 설치가 간편하고 다양한 종류의 액체와 호환된다는 장점이 있다. 액체가 튜브 내부에만 접촉하므로 오염 위험이 낮다. 그러나 유속 조절 정밀도와 압력 제어 성능이 낮으며, 맥동 흐름 특성 때문에 혈관화 모델과 같은 민감한 응용 분야에서는 부적합할 수 있다.
2. 주사기 펌프(Syringe Pumps)
주사기 펌프는 모터로 구동되는 기계식 장치로, 하나 이상의 주사기를 이용해 액체를 정확하게 주입한다. 사용자 인터페이스가 직관적이어서 유속, 주입량, 주입 시간 등의 파라미터를 쉽게 설정하고 조정할 수 있다.
프로그래밍을 통해 연속 흐름뿐 아니라 간헐적 흐름도 구현할 수 있어, 특정 유동 패턴이 요구되는 실험에 유리하다.
하지만 다음과 같은 한계점이 존재한다.
- 유속 제어 정밀도와 반응 속도가 낮음
- 주사기 용량이 제한적이어 실험 중 주기적인 재충전이 필요함
- 액체가 주사기 내부와 직접 접촉하므로 오염 위험이 높음
- 관류 배지를 지속적으로 재활용하기 어렵다는 점
지속적으로 관류 매체를 재활용하기는 어렵다。
3.압력 기반 유동 제어기(Pressure flow controller)
압력 기반 유동 제어기는 공압 시스템을 이용해 압력을 발생시키고, 이를 통해 마이크로유체 장치 내에서 액체의 흐름을 유도한다. 이 기술의 장점으로는 높은 유속 안정성과 빠른 반응 속도를 꼽을 수 있다. 연속 흐름뿐 아니라 맥동 흐름도 제공 가능하며, 다중 장기 시스템(Multi-organ system)과의 통합도 용이하다. 적절한 관류 기술의 선택은 OOC 모델이 요구하는 유속, 압력, 유동 프로파일, 맥동성, 세포 친화성 등의 구체적인 조건에 따라 달라진다.
표 1: OOC에 사용되는 다양한 마이크로유체 기술 비교
| 퍼이스테릭 펌프(Peristaltic Pump) | 주사기 펌프(Syringe Pump) | 압력 구동 펌프(Pressure driven Pump) | |
|---|---|---|---|
| 유동 안정성 및 정밀도 | 낮음 | 중간 | 높음 |
| 시간 반응성 | 높음 | 낮음 | 높음 |
| 액체 재순환 가능성 | ☑️ | ✖️ | ☑️ (L-스위치 지원) |
| 소량 액체 주입 가능성 | 낮음 | 높음 | 중간 |
| 샘플 교반 여부 | ☑️ | ✖️ | ☑️ |
| 복잡한 유동 프로파일 생성 가능성 | ✖️ | ✖️ | ☑️ (예: LineUp 시리즈) |
왜 오간온어칩(Organ-on-Chip) 실험에 압력 제어를 사용해야 할까요?
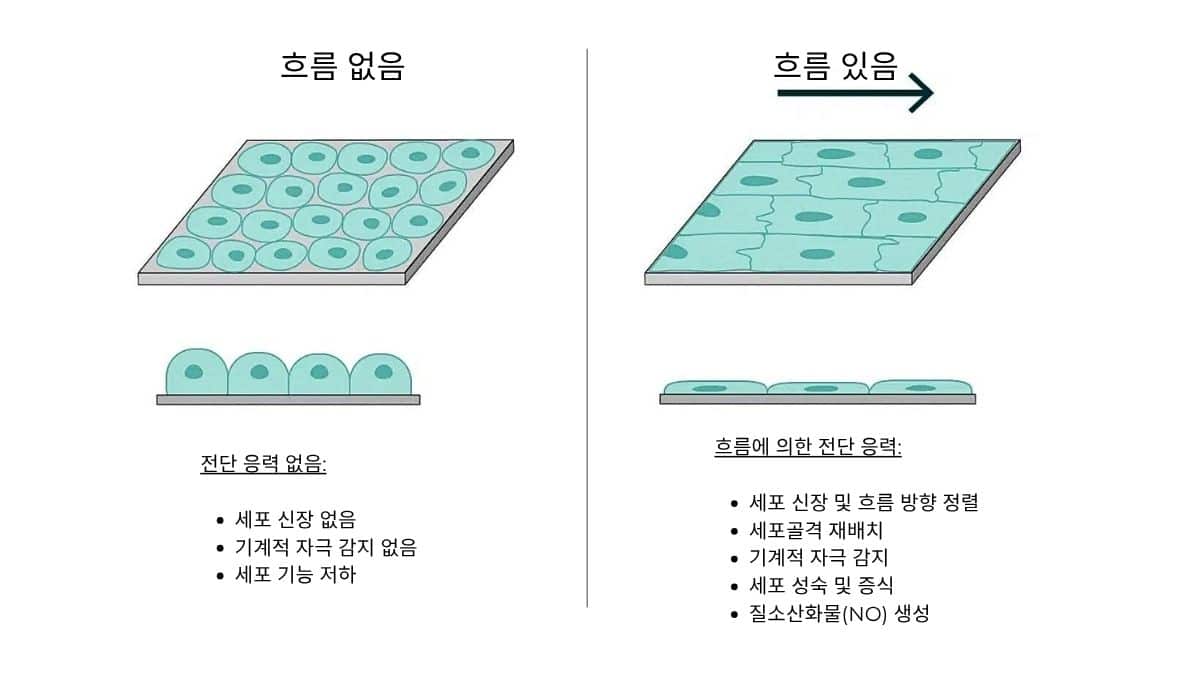
마이크로유체 압력 제어 기술을 통해 연구자들은 마이크로유체 장치 내 세포와 조직이 받는 유속, 전단 응력, 기계적 자극을 정밀하게 조절하고 생체 내 조건과 유사하게 재현할 수 있습니다. 생리학적 환경을 보다 정확하게 모사함으로써 실험 결과의 신뢰성과 재현성을 크게 향상시킬 수 있습니다.
압력은 유동의 본질적인 원동력이므로, 이를 조절함으로써 유체 역학을 미세하게 조정할 수 있으며, 생리학적 농도 기울기를 형성하고 세포의 행동, 분화 및 기능에 영향을 미치는 목표 지향적인 기계적 자극을 제공할 수 있습니다. 이러한 능력은 혈관 내 전단 응력 프로파일에서부터 간질 압력 분포에 이르기까지 복잡한 미세환경을 구축하는 핵심이 됩니다.
오간온어칩 장치 내에서 약물 전달과 관류를 정밀하게 제어하려면 정밀한 압력 조절이 필수적입니다. 이를 통해 세포 및 조직에 약물, 독성 물질 또는 기타 물질을 정량적으로 노출시킬 수 있어, 장기 기능 및 반응에 대한 영향을 평가할 수 있습니다.
오간온어칩 실험 시 고려 사항
OOC 장치의 배지 관류는 영양소와 노폐물의 대류 운반을 위한 농도 기울기를 유지하는 순환 시스템 역할을 합니다[2]. 오간온어칩 장치에 연결할 마이크로유체 액체 관류 시스템을 선택할 때는 다음의 여러 요소를 고려해야 합니다.
- 유속, 압력 제어 및 맥동성
생리학적 미세환경을 재현하기 위해서는 연구 대상 장기 시스템에 따라 생체 내 조건을 정확히 모사해야 합니다. 폐의 호흡 운동과 공기 흐름을 모사하는 폐-온-칩(lung-on-chip) 모델의 경우, 낮은 수준에서 중간 정도의 유속(분당 수 마이크로리터)과 부드러운 압력 조건이 필요할 수 있으며, 이를 통해 호흡 역학과 폐포 미세환경을 정확하게 시뮬레이션할 수 있습니다[3]. 반면 심장-온-칩(heart-on-chip) 모델과 같은 응용 분야는 심장의 리듬적인 수축을 모사하기 위해 맥동 흐름이 필요하며, 분당 수십~수백 마이크로리터의 높은 유속과 중간에서 높은 압력 제어 능력이 요구되어 생리학적인 심장 펌프 작용을 재현할 수 있습니다.
- 세포 생존율 및 전단 응력
OOC 시스템은 기계적 힘과 유체 조건에 민감한 살아있는 세포와 조직을 배양합니다. 과도한 전단 응력은 세포의 생존율, 증식 및 기능에 부정적인 영향을 미칠 수 있습니다. 따라서 펌프 종류에 의해 발생하는 전단 응력 수준을 고려하고, 세포 손상을 최소화하면서도 적절한 유동을 유지할 수 있는 펌프를 선택하는 것이 중요합니다. 전단 응력에 민감한 신경 세포를 사용하는 뇌 모델의 경우, 세포 네트워크의 파괴나 손상을 유발할 수 있는 높은 전단 응력 조건을 피하고 유속을 정밀하게 제어하는 것이 매우 중요합니다[4].
- 통합 및 호환성
OOC 모델은 인체 내 다양한 장기 간의 상호작용을 모사하는 것을 목표로 합니다. 예를 들어, 약물 대사 및 독성 효과를 연구하기 위해 간-온-칩(liver-on-chip)과 폐-온-칩(lung-on-chip)을 직렬로 연결할 수 있습니다. 각 장기 모델에 사용되는 시스템은 서로 다른 칩 간의 유체 흐름과 정보 교환을 가능하게 하도록 최적화되어야 합니다. 일부 OOC 모델은 pH 측정, 산소 농도 조절, 전기적 활동 센서 등을 포함할 수도 있으므로, 마이크로유체 압력 제어기와의 호환성을 고려하는 것이 중요합니다. 또한 장기 배양과 이미징/분석 기술은 모든 OOC 실험에서 핵심 요소이므로, 마이크로유체 플랫폼과 생물안전작업대, 이미징 장비, 분석 장비 간의 호환성(위치, 샘플 접근성, 광학 투명성 등)도 신중히 검토해야 합니다.
- 오염 위험
체외(in vitro) 모델 개발에서 일관성 있고 재현 가능한 결과를 얻기 위해서는 무균 환경을 유지하는 것이 필수적입니다. 일부 펌프 설계는 액체가 내부 부품과 직접 접촉하게 되어 오염 위험이 높아질 수 있습니다. 오간온어칩(OOC) 실험에서는 액체가 내부 구성 요소와의 접촉을 최소화하거나 완전히 차단하는 펌프를 사용하는 것이 바람직합니다.
마이크로유체 압력 제어 이해하기
OOC를 위한 압력 제어기
마이크로유체 시스템에서는 동적 미세환경을 시뮬레이션하고, 장기 실험을 위한 안정적인 조건을 유지하며, 유동 방향을 정밀하게 제어할 수 있도록 서로 협업하는 다양한 구성 요소들이 있습니다.
| 구성 요소 | 기능 | OOC 시스템에서의 역할 |
|---|---|---|
| 압력 공급원 | 유체 이동의 원동력인 압력을 생성하고 조절 | 조직/장기 모델을 통한 배지 관류 |
| 압력 및 유량 센서 | 마이크로채널 내부의 압력과 유속을 실시간으로 모니터링 | 민감한 세포에 손상을 주지 않으면서 생리학적 압력/유동 조건 유지 |
| 압력 제어기 | 센서의 피드백을 기반으로 유동을 조정하여 설정된 조건 유지 | 안정적인 장기 배양 및 칩 내 환경 변화(예: 세포 과성장으로 인한 막힘)에 대한 동적 반응 |
| 밸브(Valves) | 마이크로채널 내 유체의 흐름을 유도, 개방 또는 차단 | 다중 분석, 배지 재순환, 시간 제어 자극, 다중 장기 상호작용 연구 가능 |
| 피드백 제어 시스템(예: 소프트웨어 제어) | 실시간 데이터를 활용해 압력 또는 유량을 동적으로 조정 | 맥동 흐름 구현, 자동화된 워크플로우 지원, 생리적 동 |
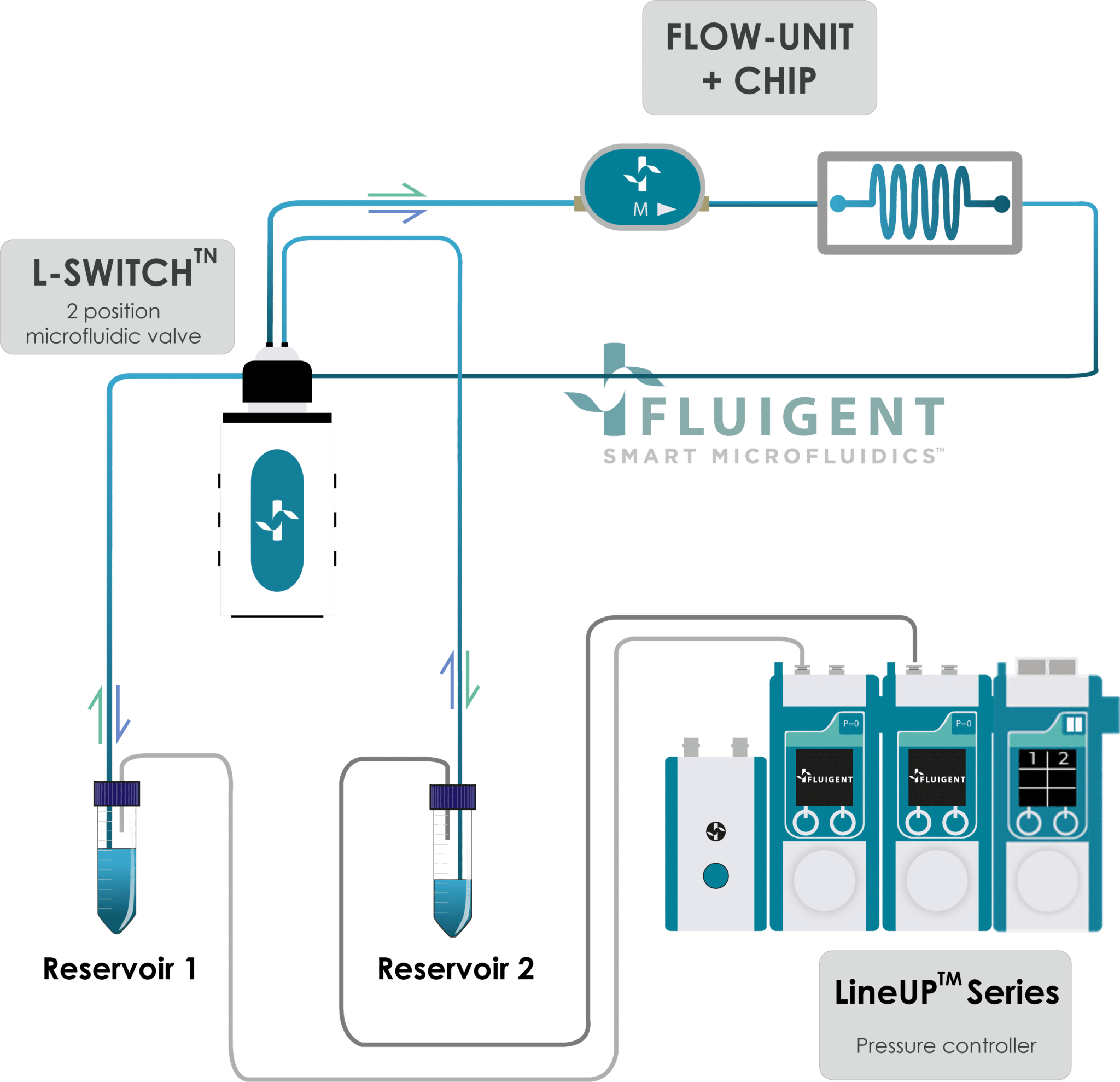
이러한 구성 요소들을 통합함으로써 연구자들은 Fluigent의 마이크로유체 압력 제어 시스템(그림 2)을 효과적으로 활용하여 오간온어칩(OOC) 내에서 배지를 순환시키며 정밀한 유체 환경을 구현할 수 있습니다.
이 설정은 Beonchip과의 협업을 통해 검증되었으며, 기존의 퍼이스테릭 펌프와 비교하여 유동 안정성이 세포 행동에 미치는 영향을 평가하였습니다. 특히 내피세포는 유속의 미세한 변화에도 매우 민감하기 때문에, 오간온어칩 연구에서 생리학적으로 의미 있는 결과를 얻기 위해서는 일정한 전단 응력을 유지하는 것이 매우 중요합니다
Omi: 통합형 오간온어칩(Organ-on-a-Chip) 유체 플랫폼
Fluigent의 검증된 압력 기반 마이크로유체 시스템을 기반으로 개발된 Omi 플랫폼은 오간온어칩(OOC) 실험 분야에서 복잡한 유체 조작 프로토콜을 관리하기 위한 모듈식 통합 솔루션으로, 압력 공급원, 센서, 밸브가 일체로 통합되어 있다.
기존의 Fluigent 시스템 기능을 확장하도록 설계된 Omi는 정밀한 압력 조절, 유동 제어, 자동 유체 전환을 위한 통합 인터페이스를 제공하여 관류, 순환, 주입, 샘플링과 같은 프로토콜을 재현성 있게 실행할 수 있도록 한다.
주요 기술적 특징:
- 약물, 독성 물질, 대사산물 등 다양한 물질의 테스트에 적합한 프로그래밍 가능한 유체 조작 루틴
- 범용 어댑터를 통한 다양한 칩과의 호환성으로, 다양한 OOC 장치와의 통합 가능
- 와이파이(Wi-Fi) 및 태블릿 애플리케이션(Android 기반)을 통한 원격 조작
- 원활한 모니터링과 실험 추적이 가능한 클라우드 기반 데이터 저장

Fluigent 시스템을 활용한 오간온어칩 응용 분야
최근 몇 년간 오간온어칩(Organ-on-a-Chip, OOC) 모델은 놀라운 발전을 이루어 왔으며, 특히 신장-온-칩(kidney-on-a-chip)[2][8], 폐-온-칩(lung-on-a-chip)[3], 심장-온-칩(heart-on-a-chip)[5], 피부-온-칩(skin-on-a-chip)[6], 췌장-온-칩(pancreas-on-a-chip)[7], 뇌-온-칩(brain-on-a-chip)[8] 등의 모델이 주목받고 있습니다. 이러한 시스템에서 발생하는 핵심 과제들을 해결하는 데 있어 압력 제어 마이크로유체 기술은 다음과 같은 방식으로 중요한 역할을 해왔습니다.
- 생체 내 관류 조건을 더욱 정확하게 모사하기 위한 제어된, 방향성 있는 유체 노출 제공
- 정밀한 약물 투여 연구를 위한 농도 기울기(gradient flow) 형성
- 복잡한 장기 구조를 재현하기 위한 다중 세포 유형의 공배양(co-culture) 및 공간적 층화 구조 구현
- 전통적인 동물 모델보다 생리학적으로 더 유의미한 모델을 구축하기 위한 인간 유래 세포 활용
마이크로유체 기반 OOC 플랫폼은 맞춤형 의학(personalized medicine), 고속 약물 스크리닝(high-throughput drug screening), 단일 세포 분석, 세포 간 상호작용 연구, 질병 모델링 분야의 연구를 혁신적으로 변화시키고 있으며, 이는 인간 생리학에 대한 깊이 있는 이해와 보다 효과적인 치료제 개발로 이어지고 있습니다.
전 세계의 연구자들은 오간온어칩 모델을 개발하고 연구하기 위해 Fluigent의 마이크로유체 압력 제어 시스템을 널리 채택하고 있습니다.
Omi 사용자 후기

« I’m thrilled to share that I’ve used Omi on numerous occasions for my cell biology experiments as part of my PhD. Omi is the simplest tool I’ve been able to use for on-chip organ recirculation and perfusion. Everything is integrated into a single device, and the sterile consumables are easy to use, which greatly reduces the risk of contamination.
Tablet and web applications allow real-time monitoring of experiments in progress, making it the perfect user-friendly tool. I’m really excited to be able to develop new biological applications with Omi! »
Arthur Salles – PhD Student CNRS LIED – Université Paris Cité – France
혈관-온-칩(Vessel-on-a-Chip)
여러 개의 혈관-온-칩(Vessel-on-a-Chip, VoC) 모델에서 안정적인 유동 조건을 구현하는 데 따르는 과제들을 극복하기 위해, Valeria Orlova 연구팀[10]은 통합된 제어 파라미터 세트를 사용하여 최대 12개의 3D-VoC를 동시에 관류할 수 있는 유체 회로 기판(Fluidic Circuit Board, FCB)을 개발하였다.
Fluigent의 FlowEZ 압력 제어기, Link-Up 모듈 및 유량 센서를 통합함으로써, 이 시스템은 내피세포 기능과 혈관의 구조적 완전성을 유지하는 데 핵심적인 일관된 관벽 전단 응력(wall shear stress) 및 혈역학적 힘을 보장한다.
이러한 다중화 방식은 3D 혈관 모델의 확장성과 표준화를 위한 중요한 진전을 의미한다.

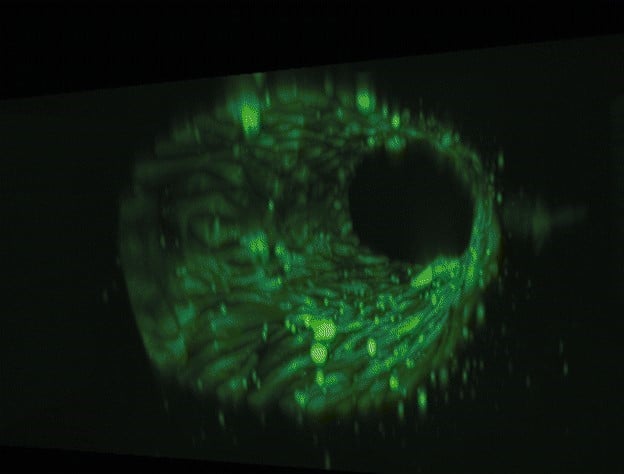
그림 4: 가열 블록 내 외부 배지 저장소에 연결된 테스트용 유체 회로 기판 사진 및 칩 상의 혈관에 대한 3D 재구성 이미지.
암-온-칩(Cancer-on-a-Chip)
Van Gent 연구팀은 제어된 배양 조건 하에서 종양 조직 절편을 활용해 환자 치료 반응을 평가할 수 있는 암-온-칩(Cancer-on-a-Chip) 마이크로유체 플랫폼(그림 6)을 개발하였다[11]. 이들의 마이크로유체 압력 제어 시스템은 Fluigent의 고속 처리 플랫폼인 MFCS-EZ로 구성되어 있으며, 유방암 및 전립선암의 PDX(환자 유래 이식) 종양 절편의 생존율을 유지하고 최대 14일간 지속적인 증식을 달성하였다. 또한, 이들은 종양 절편에 대한 시스플라틴 화학요법의 반응을 연구하였다. 본 플랫폼은 향후 동일한 화학요법으로 치료될 환자 생검 조직을 이용한 연구에 활용될 수 있다.
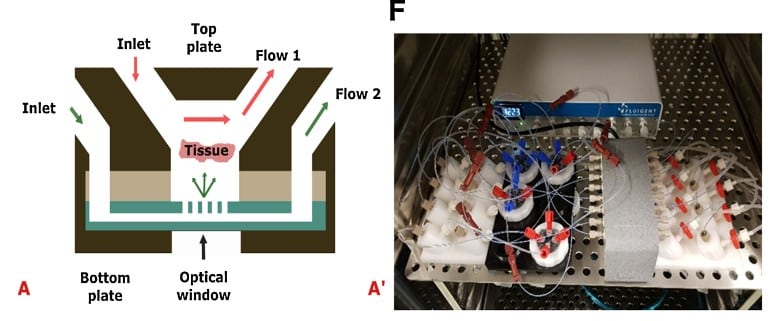
그림 6: (A) 조직 절편으로의 확산 및 관류를 보여주는 암-온-칩 시스템의 단면도. (A’) 배양 기간 동안 Fluigent 소프트웨어를 통해 연결된, Fluigent 마이크로유체 유동 제어 시스템에 연결된 암-온-칩 플랫폼 및 Fluigent FLOW UNIT-S 유량 센서.
연골-온-칩(Cartilage-on-a-Chip)
Séverine le Gac 연구팀은 연골세포가 외부 자극(기계적 또는 화학적)에 어떻게 반응하는지를 시뮬레이션하고, 퇴행성 관절염과 같은 연골 질환의 유발 메커니즘을 이해하기 위해 마이크로유체 제어 시스템(MFCS-EZ, 2개의 스위치 및 스위치보드)을 활용한 연골-온-칩 모델을 개발하였다[12](그림 7). 이 설정은 3D 세포 배양에 기계적 자극을 적용하고, 자극 후 세포 반응을 현장에서 실시간으로 분석하는 동시에 동적 배양 조건을 구현한다.
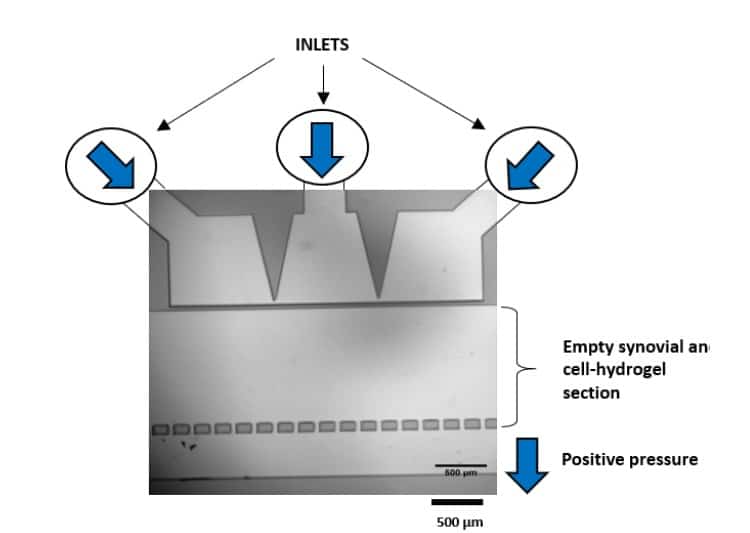
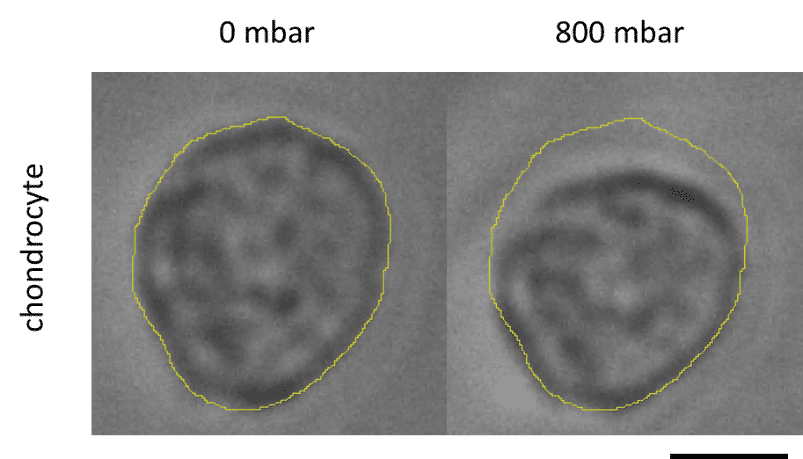
그림 7: 기계적 자극 후 연골세포의 변형.
장-온-칩(Gut-on-a-Chip) 모델
릴 파스퇴르 연구소(Institut Pasteur de Lille)의 연구진은 장 건강 및 숙주-병원체 상호작용 연구를 위한 오간온어칩 기술 접근성을 높이기 위해, 저비용이면서 사용이 간편한 장-온-칩(Gut-on-Chip, GoC) 플랫폼인 3DP-µGut을 개발하였다.
기존의 GoC 시스템이 고가의 상용 칩, 고난이도 CAD 기술, 청정실 시설에 의존하는 것과 달리, 3DP-µGut은 표준 SLA 방식의 3D 프린터와 무료로 제공되는 설계 파일을 사용하여 제작된다. 이를 통해 저비용으로 반복 가능하고 이미징에 적합한 칩을 중간 규모로 생산할 수 있다.
이 모델은 Caco-2 세포를 이용하여 검증되었으며, 7일 후 3D 상피조직으로 분화되어 실제 장 조직 구조를 매우 유사하게 모사하였다. 개방형 설계로 인해 다양한 마이크로유체 시스템과 호환 가능하며, 검증 과정에서는 Fluigent의 통합 플랫폼 Omi 및 FlowEZ 압력 제어기가 사용되었다.
GoC 구현, 유동 제어 전략, 숙주-미생물군 상호작용 모델링 접근법에 대해 더 알고 싶다면:
웨비나: 장-온-칩 모델을 중심으로 본 오간온어칩에서 유동의 중요성
릴 파스퇴르 연구소의 전문가가 Omi 자동화 플랫폼을 기반으로 한 장-온-칩(GoC) 모델을 소개하며, 그 응용 분야와 장점을 설명합니다.
결론
압력 제어 마이크로유체 기술은 정밀하고 안정적이며 반응성이 뛰어난 유체 조작을 제공함으로써 오간온어칩(OOC) 연구를 선도하는 핵심 기술이다. 다른 기술들과 비교할 때, 압력 기반 시스템은 생리학적 조건을 더욱 정확하게 재현하여 장기적인 세포 생존율, 실험의 재현성, 복잡한 유동 프로파일 구현을 지원한다. 혈관 전단 응력 시뮬레이션에서부터 다중 장기 상호작용까지, 압력 제어는 OOC 플랫폼에서 최적의 성능과 신뢰성을 보장한다. Fluigent의 통합 시스템과 같은 솔루션을 통해 연구자들은 자신들의 OOC 실험에 맞춤형 설정을 손쉽게 구현할 수 있게 되었다.
추가 정보 또는 기술 상담을 원하시면
관련 제품
관련 전문 기술
References 참고 문헌
- Leung CM, de Haan P, Ronaldson-Bouchard K, et al. A guide to the organ-on-a-chip. Nat Rev Methods Primers. 2022;2:33. doi:10.1038/s43586-022-00118-6
- Lee SKJ. Kidney-on-a-Chip: a new technology for predicting drug efficacy, interactions, and drug-induced nephrotoxicity. Curr Drug Metab. 2018;19(7):577–583.
- Zamprogno P, Wüthrich S, Achenbach S. Second-generation lung-on-a-chip with an array of stretchable alveoli made with a biological membrane. Commun Biol. 2021;4:168.
- Regmi S, Fu A, Luo K. High shear stresses under exercise condition destroy circulating tumor cells in a microfluidic system. Sci Rep. 2017;7:39975. doi:10.1038/srep39975.
- Liu H, Bolonduro OA, Ning Hu JJ, Rao AA, Duffy BM, Huang Z, et al. Heart-on-a-Chip model with integrated extra- and intracellular bioelectronics for monitoring cardiac electrophysiology under acute hypoxia. Nano Lett. 2020;20(6):2585–2593.
- Lukács B, Bajza Á, Kocsis D, Csorba A, Antal I, Ivan K, et al. Skin-on-a-Chip device for ex vivo monitoring of transdermal delivery of drugs—design, fabrication, and testing. Pharmaceutics. 2019;11(9):445.
- Mun KS, Arora K, Huang Y. Patient-derived pancreas-on-a-chip to model cystic fibrosis-related disorders. Nat Commun. 2019;10:3124.
- Raimondi LI, Tunesi M, Comar M, Albani D, Giordano C, et al. Organ-On-A-Chip in vitro models of the brain and the blood–brain barrier and their value to study the microbiota–gut–brain axis in neurodegeneration. Front Bioeng Biotechnol. 2020;8:435.
- Menéndez AC, Du Z, van den Bosch TPP, Othman A, Gaio N, Silvestri C, et al. Creating a kidney organoid vasculature interaction model using a novel organ-on-chip system. Sci Rep. 2022;12(1):20699
- de Graaf MNS, Vivas A, Kasi DG, van den Hil FE, van den Berg A, van der Meer AD, Mummery CL, Orlova VV. Multiplexed fluidic circuit board for controlled perfusion of 3D blood vessels-on-a-chip. Lab Chip. 2023; 23:68-181.
- Chakrabarty S, Quiros-Solano WF, Kuijten MMP, Haspels B, Mallya S, Lo CSY, et al. A microfluidic cancer-on-chip platform predicts drug response using organotypic tumor slice culture. Cancer Res. 2022;82(3):510-520
- Paggi CA, Hendriks J, Karperien M, Le Gac S. Emulating the chondrocyte microenvironment using multi-directional mechanical stimulation in a cartilage-on-chip. Lap Chip. 2022;22(9):1815-1828