미세유체 관류 최적화: 모범 사례와 혁신
장기칩, 생세포 이미징, 약물 검사 및 고급 유량 제어 시스템을 위한 미세유체 관류의 모범 사례를 살펴보세요.
미세유체 관류란 무엇인가
‘미세유체 관류(microfluidic perfusion)’의 정의와 일반적인 연속 유동과의 차이점:
관류(perfusion)란 일반적으로 조직이나 채널 같은 구조를 통해 유체를 제어하여 공급하는 과정으로, 주로 의학적 용어에 기반한다. 미세유체학에서의 관류는 미세 채널을 통한 유체의 연속적 흐름을 의미하며, 이는 주로 조직이나 반응 구역을 가리킨다. [1][2]
이 분야가 지속적으로 발전함에 따라, 미세유체 관류는 생세포 분석, 장기칩(organ-on-a-chip) 플랫폼, 단일 분자 검출(single-molecule detection)과 같은 고감도 분석에서 핵심적인 역할을 담당하게 되었다. 관류가 연속적, 다중(multiplexed), 혹은 순차적(sequential)으로 구현되더라도, 유동 속도, 층류(laminar)와 난류(turbulent)의 차이, 흐름 방향성과 같은 유체 역학을 정밀하게 제어하는 것이 필수적이다.
표 1. 생명과학 연구에서 미세유체 관류의 중요성
| 응용 분야 | 활용 |
|---|---|
| 장기칩 / 동적 세포 배양 | 영양분·산소 교환, 노폐물 제거, 전단 응력(shear stress) 등 생리학적으로 중요한 유동 조건을 모사하기 위해 배지를 지속적으로 관류하여 생체 내 유사 미세환경을 구현함. |
| 실시간 세포 이미징 / 장기 현미경 관찰 | 이미징 세션 동안 영양분 및 시약을 공급하여 세포 생존력을 유지하고, 세포 과정을 실시간으로 관찰 가능하게 함. |
| 약물 반응 테스트 | 약리학적 물질을 동적으로 주입 및 샘플링하여 농도 의존적 세포 반응을 평가, 이를 통해 고속 스크리닝과 독성 평가를 지원함. |
| 관류 바이오리액터 및 세포 분리 | 세포, DNA, 엑소좀 등 생물학적 시약을 대량 생산하고 이를 분리 및 검증하기 위해 지속적 관류를 적용한 확장형 시스템. |
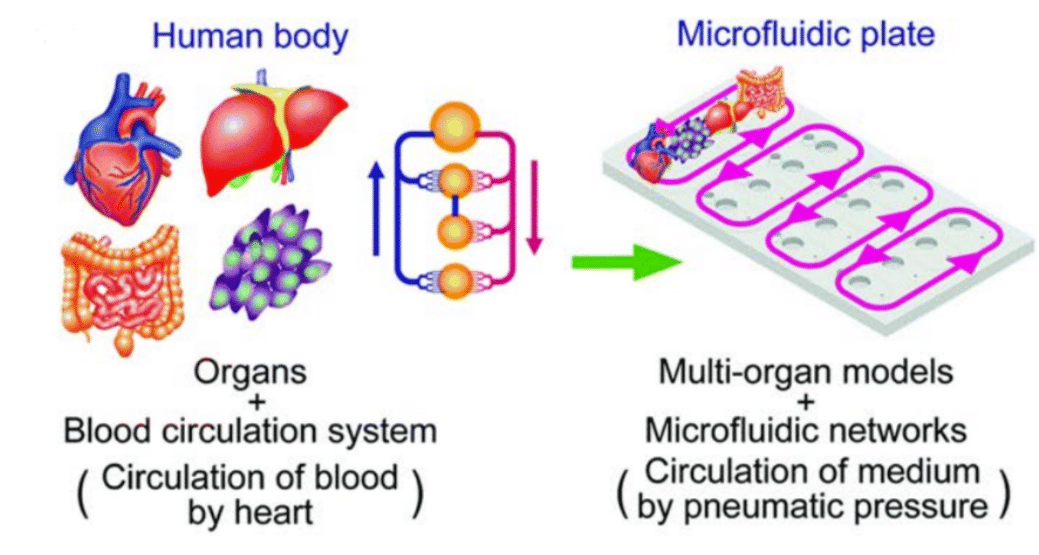
장기칩 연구에서 관류는 정적 배양(static culture)과 달리 생체 내와 유사한 미세환경을 조성한다. 관류는 반복적인 수동 조작과 환경 변동을 피함으로써 무균적이고 안정적인 환경을 제공한다. 이러한 안정성은 실시간 세포 이미징, 칼슘 수송체 모니터링, 약물 테스트와 같은 장기적 실험을 가능하게 한다. 관류 시스템은 세포 생존율을 장기간 향상시키고, 여러 화합물에 대해 정밀하고 용량 제어된 노출을 가능하게 한다.
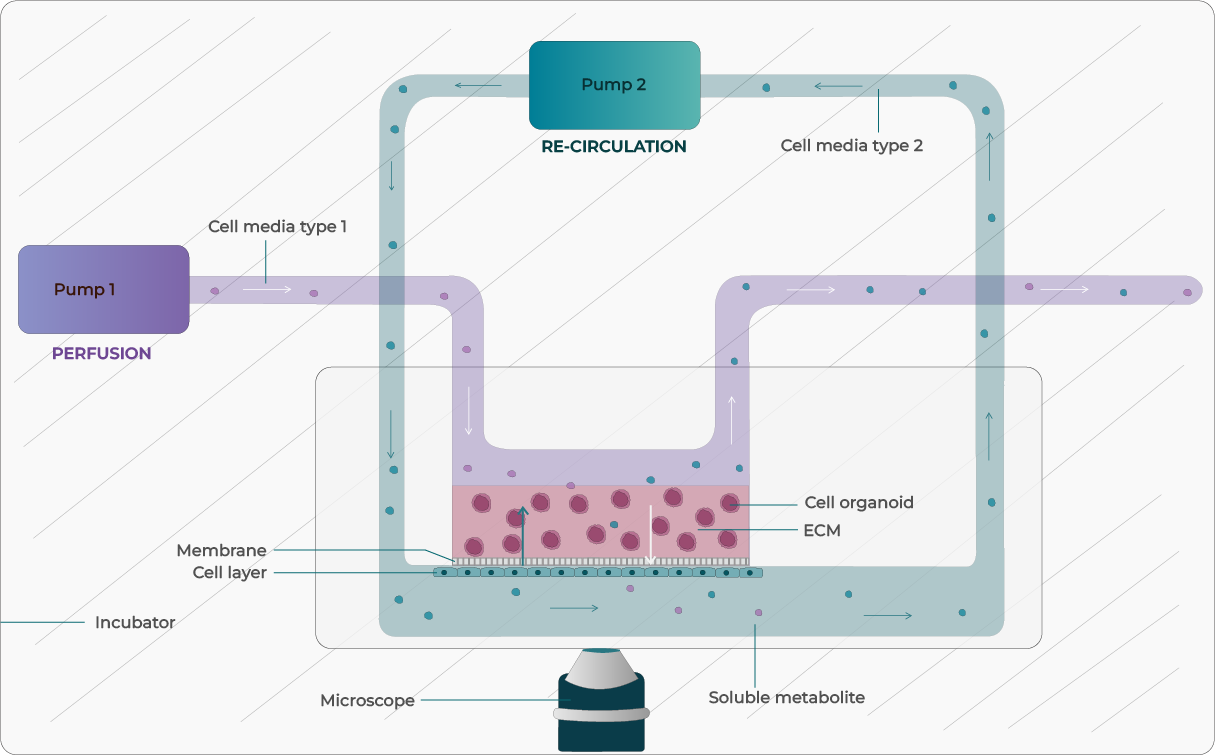
그림 1. 장기칩(OoC) 시스템에서의 미세유체 관류 (개방 루프와 폐쇄 루프, 즉 재순환 방식)
미세유체 관류의 모범 사례
효과적인 관류는 적절한 재료, 정밀한 채널 구조, 그리고 생물학적 또는 화학적 응용을 지원하는 설계 전략의 통합에 달려 있다.
응용 요구사항에 따른 재료 선택
응용 분야에 따라, 미세유체 칩의 재료 선택은 기계적 특성, 화학적 호환성, 가스 투과성 등의 변수에 영향을 받으며, 이는 특정 응용에 맞게 조정될 수 있다. 이러한 선택은 연구와 목표로 하는 생물학적 모델링에 의해 결정된다.
다양한 미세유체 칩 재료:
- PDMS(폴리디메틸실록산): 가스 투과성이 있어 산소 공급 목적에 선택되지만, 소수성 분자를 흡수할 수 있어 약물 독성 검사에 영향을 줄 수 있음 [3].
- 유리 및 열가소성 수지(PMMA, COC 등): 화학적으로 안정적이고 흡착이 적으며, 용출(leaching)을 최소화해야 하는 응용에 적합.
- 하이드로겔: 완전히 유연한 미세유체 시스템에서 생체적합성 지지체로 부상 중이며, 특히 조직 모사 및 3D 배양 환경에서 활용됨 [4].
인체의 각 조직은 기능과 형태가 다르므로 생체 모사 모델은 이러한 차이를 고려해야 한다. 예를 들어, 뼈(Young’s modulus ~20 GPa)를 모사하는 데 적합한 재료는 뇌 조직(Young’s modulus ~2 kPa) [5][6]을 모사하는 재료와 크게 다르다. 저산소 환경에서는 유리나 저투과성 열가소성이 선호되며, 연조직 모델링에는 유연한 막이나 하이드로겔이 더 적합하다.
재료 선택 외에도, 원하는 생물학적 기능을 지원하기 위해 내부 표면에 다양한 처리를 할 수 있다:
- 세포 부착력 향상: ECM 단백질(피브로넥틴, 콜라겐 등) 코팅.
- 비특이적 흡착 방지: PEGylation, BSA 코팅, 기타 항오염 코팅 적용 [7].
- 플라즈마 산화 또는 화학적 기능화를 통해 친수성과 젖음성을 향상시킬 수 있음.
칩의 기하학적 구조와 치수 최적화
채널 설계는 미세유체 시스템 내 유체 역학과 세포 반응에 영향을 미친다. 미세환경의 구조는 세포가 받는 기계적 신호에 영향을 주며 [8], 채널의 치수와 부피는 시약 확산 및 이후 생물학적 상호작용에 영향을 미친다.
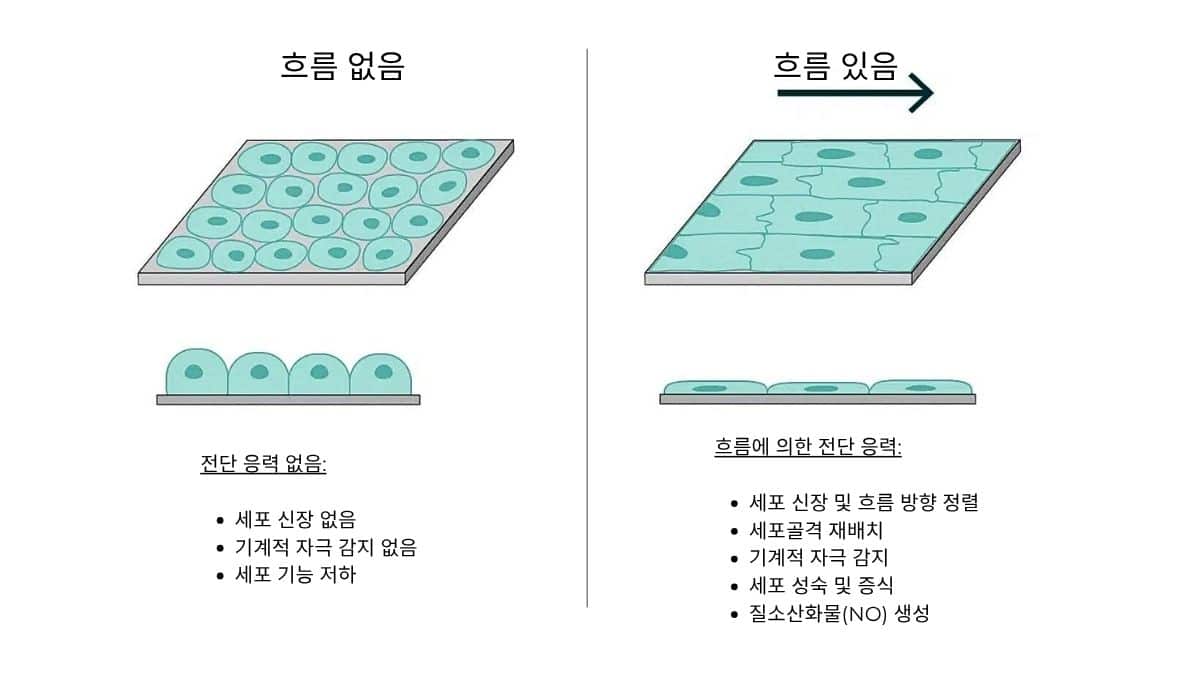
- 전단 응력(shear stress)은 세포의 형태, 이동, 유전자 발현 등 핵심적인 세포 반응에 영향을 미친다. 유동 조건은 채널의 기하학적 구조와 유속을 고려하여, 세포 유형에 따라 생체 내와 유사한 전단 응력 범위(보통 1–20 dyn/cm²)에 맞추어야 한다.
- 관류 채널의 치수는 시약 확산과 샘플 노출 시간에 영향을 준다. 확산은 분자의 이동에 기여하지만, 관류 분석에서 세포 반응에 지배적인 요인은 시약의 대류 흐름이다 [9]. 채널 치수와 유속을 정밀하게 제어해야 세포가 정의된 시약 농도와 시간적 프로필에 노출된다. 채널 치수의 변동은 유속과 체류 시간을 바꾸어 불균일한 시약 전달이나 확산 지배적 수송을 유발하고, 이는 농도 구배를 흐리게 하여 분석의 재현성을 떨어뜨린다. 시약 관류를 최적화하도록 채널을 설계하면, 정량적 생물학적 분석에 필수적인 재현 가능한 세포 반응을 확보할 수 있다.
- 미세유체 장치를 적절히 밀봉하는 것은 제어된 유체 환경을 유지하는 데 필수적이다. 개방된 포트, 잘못 접합된 층, 덮이지 않은 막 등에서 발생한 누출은 원치 않는 유동 경로나 교차 오염, 시약 손실을 초래할 수 있다. 이는 유체 역학을 교란시킬 수 있으므로, 누출을 감지하고 방지하는 것이 중요하다. 적절한 접착제, 접합 기술, 기계적 클램프를 사용한 정밀한 밀봉은 장치의 무결성을 보장하며, 특히 다층 칩이나 공동 배양 칩에서 공간적 분리가 필수적인 경우에 중요하다. 또한, 적절한 밀봉은 멸균 작업을 용이하게 하고, 공기 유입을 막아 기포 생성을 줄인다.
! 미세유체 장치 사용 시 참고사항:
상용 미세유체 칩이나 유동 셀을 사용할 때는, 시스템 설정을 보정하고 재료의 광학적·화학적·물리적 특성을 고려해야 한다. 예를 들어, PDMS는 소수성 분자를 흡수하여 용량 정확성에 영향을 줄 수 있으며, 하이드로겔 기반 칩에서는 막 누출이나 변형 문제가 관류 전 멸균성과 밀봉을 저해할 수 있다.
균일한 흐름을 위한 기포 방지
기포는 연속 흐름을 방해하는 요인이 될 수 있다. 3D 세포 배양에서는 세포 손상을 일으키고, 분석에서는 유동 프로필의 균일성을 방해한다.
- 일정한 온도 유지: 온도 변동은 용해된 가스가 기포로 핵생성되게 할 수 있다. 예를 들어, 섭씨 몇 도의 온도 상승만으로도 가스 용해도가 낮아져 기포 형성이 유도될 수 있다 [10].
- 기포 방지 전략에는 사용 전에 배지를 탈기하거나, 버블 트랩이나 인라인 탈기 막을 사용하여 관류를 방해할 수 있는 기포를 포획·제거하는 방법이 있다. 칩 내에 버블 트랩이나 탈기 막을 통합하면, 민감한 세포 배양 영역에 도달하기 전에 물리적으로 기포를 제거할 수 있다.

그림 2. 미세유체 채널에서 기포 핵생성의 열영상
유동 제어를 위한 적절한 관류 펌프 선택
적절한 펌프 유형과 유동 제어 방식 선택은 기술적 사양 정의에 달려 있다. 미세유체 관류에는 여러 장비가 사용된다:
- 압력 구동 펌프는 빠른 응답 시간과 함께 정밀하고 프로그래밍 가능한 유동 프로필을 제공하여, 안정적이고 낮은 맥동 유동이 필요한 민감한 응용에 이상적이다. 이러한 안정성은 층류(laminar flow)를 유지하는 데 도움이 되며, 생체 내 전단 응력 재현에 필수적이다.
- 실린지 펌프는 약 0.25%의 정확도로 일정한 유속을 제공하지만, 수동 리필 과정에서 흐름이 중단되고 맥동이 발생하여 민감한 세포나 반응에 영향을 줄 수 있다.
- 맥동 펌프는 사용이 편리하지만, 본질적으로 맥동 유동을 생성하여 세포에 스트레스를 주고 정량적 분석을 복잡하게 만든다. 이는 세포 생존율에 큰 영향을 준다.
유체 제어 기술에 대한 포괄적인 검토는 다음과 같습니다.
적절한 관류 기술 선택 외에도, 정기적으로 보정과 청소를 하는 것이 중요하다. 예를 들어, 유동 센서에 바이오필름이 쌓이면 측정이 드리프트되고, 작은 유속 편차만으로도 전단 응력과 세포 반응이 크게 달라져 데이터 신뢰성에 영향을 줄 수 있다.
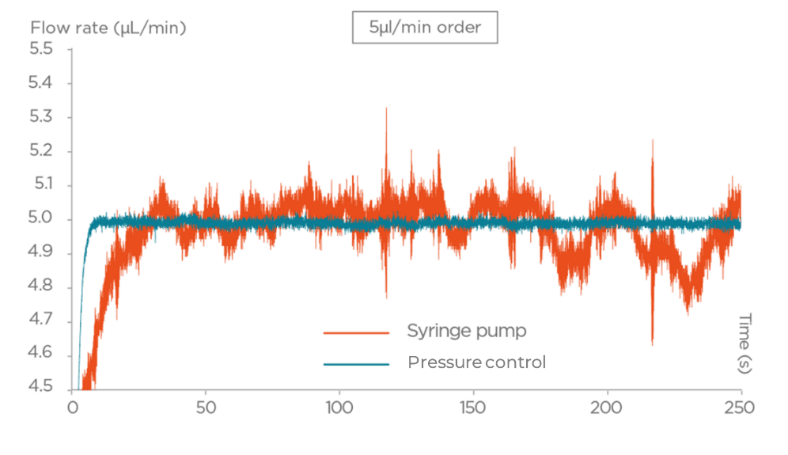
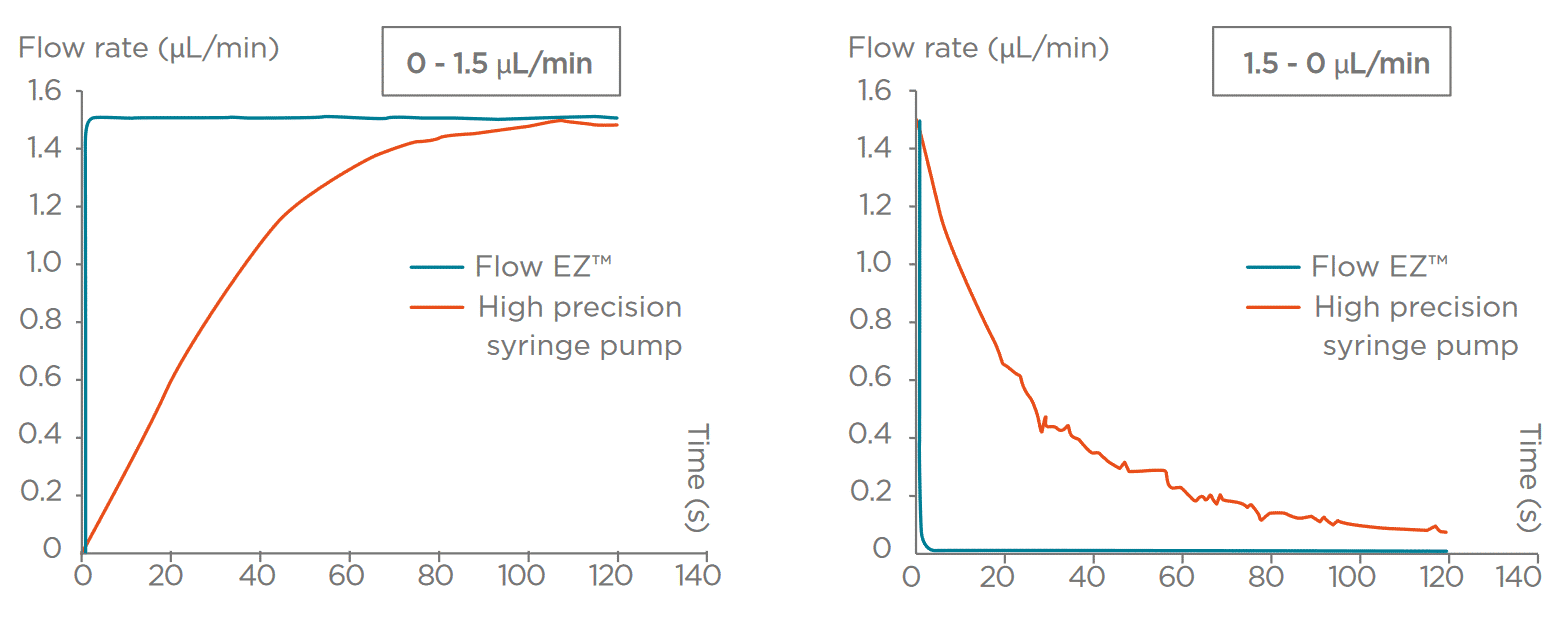
그림 3. 압력 구동 유동 제어기와 실린지 펌프의 성능 비교
미세유체 연속 흐름의 혁신
자동화된 다중화 시스템
미세유체에서 유동을 다중화하는 혁신적인 접근은, 다수의 입력 및 시약을 정밀하게 관리하고 병렬 채널에서 안정적인 액체 분배를 보장하는 과제를 해결한다. 다중 포트를 제어할 수 있는 압력 구동 미세유체에서는 특정 매니폴드를 설계하여 병렬 시약 공급과 배지 재순환이 가능하다.
최대 10종의 시약을 순차적으로 전달하기 위해 Aria를 사용하면 칩에 최대 10가지 시약을 관류할 수 있으며, 해당 소프트웨어는 자동 주입을 지원한다.
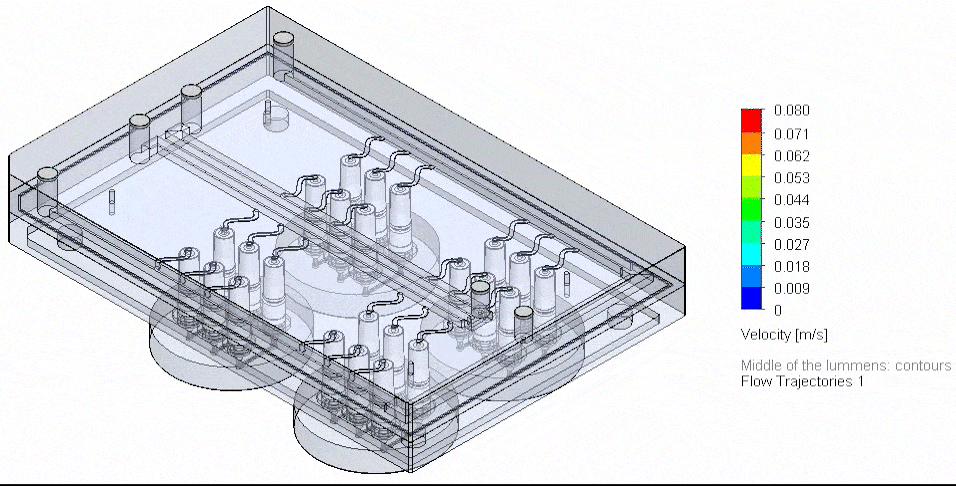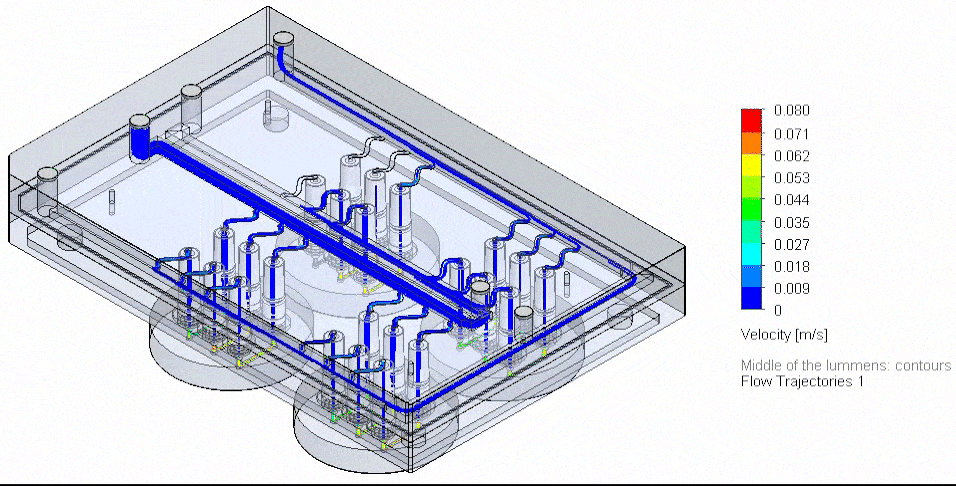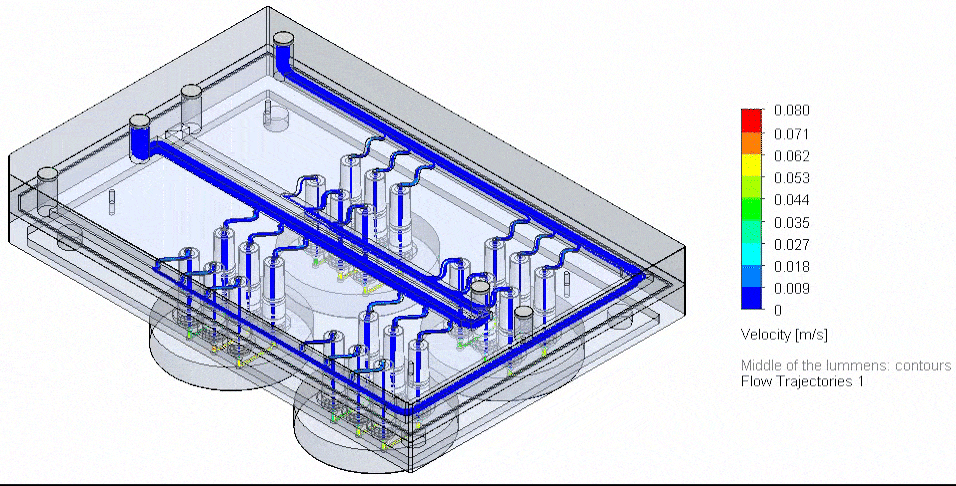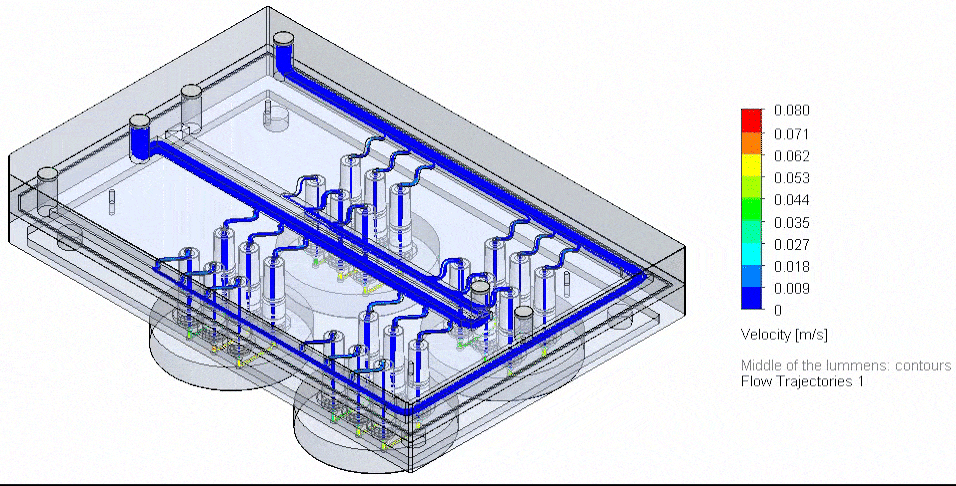
그림 4. 3D-VoC 모델 기반 유동 보드 자동화 흐름도
통합 실시간 감지
칩 내 또는 인라인 센서(광학·전기화학 프로브, 염증 마커용 바이오센서 등)의 통합이 연구에 사용되어 실험 결과를 분석하고 측정한다. 폐쇄 루프 제어는 이러한 센서가 배양 환경을 실시간으로 지속적으로 모니터링하고, 데이터를 사용하여 관류 매개변수를 자동 조정할 수 있게 한다. 이는 세포 건강과 재현성에 필수적인 안정적 생리 조건을 보장한다. 한 예로, 흐르는 배지 내 pH와 용존 산소를 추적하기 위해 개발된 소형 광학 센서 배열이 있으며, 이는 관류 중 목표 조건을 유지하기 위한 동적 조정을 가능하게 한다 [11].
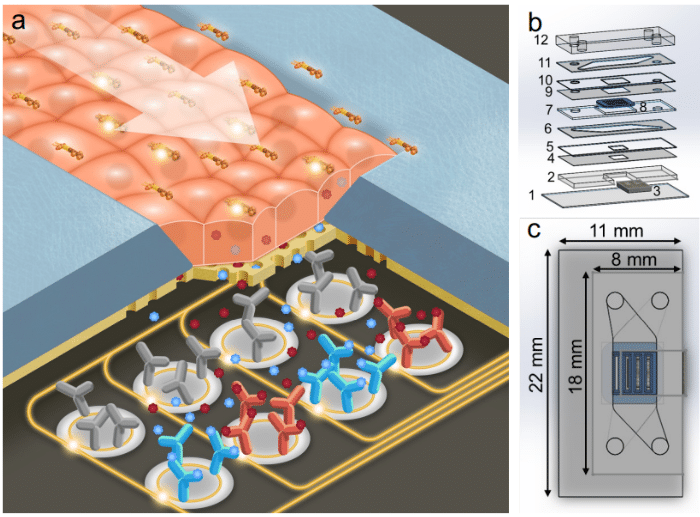
그림 5. 광학 센서가 통합된 조직 칩 (a. 작동 원리 개략도, b. 층별 분해도, c. 외형 상단도)
장기칩 배지 관류
장기칩 기술의 채택이 증가하면서, 모델의 생리학적 요구를 충족시키기 위한 기술적 적응이 이루어졌다. 폐쇄 루프 재순환은 무균성 보장, 장기 재순환, 시약 비용 절감, 관심 있는 세크레톰(secretome) 증폭 등의 이점을 제공한다.
Fluigent의 Omi 플랫폼과 같은 연속 미세유체 관류 시스템은 정밀하고 프로그래밍 가능한 유동 제어를 제공하여, 장벽 무결성, 조직 구조, 장기적 생존력을 유지함으로써 조직 특이적 환경을 재현하도록 설계되었다. 이는 반복 투여와 장기 배양을 지원하여 약물 스크리닝 분석의 예측 능력을 향상시킨다. TissUse의 압력 장치는 이들이 자체 OoC를 조작할 수 있게 한다.
장기칩 유체 플랫폼 Omi의 기능에 대해 더 알아보기

그림 6. 광학 현미경 하의 Omi 시스템
미세유체 관류의 발전
미세유체 관류는 개별 시스템에서 고도로 통합되고, 지능적이며, 확장 가능한 플랫폼으로 발전하고 있다. 앞으로 이 분야를 변화시킬 몇 가지 새로운 경향이 나타나고 있다:
- 복잡한 다중 장기 통합 및 폐쇄 루프 시스템:
“바디온칩(body-on-a-chip)” 생태계, 즉 전신 생리학적 상호작용을 모사하기 위해 상호 연결된 조직 칩 네트워크의 증가가 예상된다. 이는 누출과 기포를 방지하기 위해 무관 연결 매니폴드 인터페이스와 결합될 수 있다.
- 신소재 및 적층 제조:
스마트 폴리머와 3D 프린팅의 발전은 정교한 맞춤형 구조를 가능하게 하여 더 다양한 생체역학적 시뮬레이션과 유동 제어를 가능하게 할 것이다. - 규제 진전 및 표준화:
관류된 미세생리학 시스템(예: 장기칩)이 규제 승인을 얻음에 따라, 표준화된 플랫폼이 약물 개발 파이프라인에 진입할 것이다. 미국 FDA 현대화법 2.0에서 OoC 채택은 장기칩 연구가 임상 응용으로 번역될 수 있게 허용한다.
여러 과제가 해결되어야 한다: 지속적 혁신을 위한 주요 초점 영역:
- 기포 형성과 유동 안정성: 기포 핵생성 문제는 여전히 지속된다. 개선된 탈기 기술과 실시간 기포 검출이 필수적이다.
- 장기적 무균성과 시스템 견고성: 장기간의 실험은 효과적인 여과, 탄력적인 밀봉, 미생물 오염 방지를 위한 중복 설계를 갖춘 폐쇄 시스템을 요구한다.
- 제조 규모 확대와 비용: 실험실 프로토타입에서 상업적 제품으로 전환하기 위해서는 내구성 있고 사용하기 편리하며, 복잡성과 경제성을 균형 있게 유지하는 시스템이 필요하다. 이는 모듈식 및 재구성 가능한 장치로 가능할 수 있다.
미래 비전: 이러한 경향과 솔루션이 융합됨에 따라, 미세유체 관류 시스템은 지능적이고 신뢰할 수 있으며 접근 가능한 도구로 발전할 것이다. 그 채택은 전문 연구소를 넘어, 주류 생물의학 연구, 약물 개발, 맞춤 의학으로 확대되며, 역동적이고 생리학적으로 관련된 새로운 시험관 내 모델링 시대를 열 것이다.
관련 솔루션
References
- Horowitz LF, Rodriguez AD, Ray T, et al. Microfluidics for interrogating live intact tissues. Microsystems & Nanoengineering. 2020;6:69. doi:10.1038/s41378-020-0164-0 nature.com
- Hattori K, Sugiura S, Kanamori T. Pressure-driven microfluidic perfusion culture device for integrated dose-response assays. J Lab Autom. 2013 Dec;18(6):437–45. doi:10.1177/2211068213503155 pubmed.ncbi.nlm.nih.gov
- Sønstevold L, Koza P, Czerkies M, Andreassen E, McMahon P, Vereshchagina E, et al. Prototyping in polymethylpentene to enable oxygen-permeable on-a-chip cell culture and organ-on-a-chip devices suitable for microscopy. Micromachines. 2024;15(7):898. doi:10.3390/mi15070898 doi.org
- Nie J, Fu J, He Y. Hydrogels: The next generation body materials for microfluidic chips? Small. 2020 Nov;16(46):e2003797. doi:10.1002/smll.202003797 pubmed.ncbi.nlm.nih.gov
- Rho JY, Ashman RB, Turner CH. Young’s modulus of trabecular and cortical bone material: ultrasonic and microtensile measurements. J Biomech. 1993;26(2):111–19. doi:10.1016/0021-9290(93)90042-D researchgate.net
- Budday S, Nay R, de Rooij R, Steinmann P, Wyrobek T, Ovaert TC, et al. Mechanical properties of gray and white matter brain tissue by indentation. J Mech Behav Biomed Mater. 2015;46:318–30. doi:10.1016/j.jmbbm.2015.02.024 pubmed.ncbi.nlm.nih.gov
- Choi Y, Tran H-V, Lee TR. Self-assembled monolayer coatings on gold and silica surfaces for antifouling applications: a review. Coatings. 2022;12(10):1462. doi:10.3390/coatings12101462 mdpi.com
- Sun B, Xie K, Chen T-H, Lam RHW. Preferred cell alignment along concave microgrooves. RSC Adv. 2017;7:6788–94. doi:10.1039/c6ra26545f pubs.rsc.org
- Huber D, Oskooei A, Casadevall i Solvas X, de Mello AJ, Kaigala GV. Hydrodynamics in cell studies. Chem Rev. 2018;118(4):2042–79. doi:10.1021/acs.chemrev.7b00317 pubmed.ncbi.nlm.nih.gov
- Pereiro I, Fomitcheva Khartchenko AF, Petrini L, Kaigala GV. Nip the bubble in the bud: a guide to avoid gas nucleation in microfluidics. Lab Chip. 2019;19(14):2296–2314. doi:10.1039/c9lc00211a pubs.rsc.org
- Azimzadeh M, Khashayar P, Amereh M, Tasnim N, Hoorfar M, Akbari M. Microfluidic-based oxygen (O₂) sensors for on-chip monitoring of cell, tissue and organ metabolism. Biosensors. 2021 Dec 22;12(1):6. doi:10.3390/bios12010006 pmc.ncbi.nlm.nih.gov