약물 전달 분야의 마이크로플루이딕스: 정밀 의학의 새로운 시대
마이크로플루이딕스(microfluidics)를 활용한 약물 전달 기술은 칩 스케일의 플랫폼에서 복잡한 실험실 공정의 소형화 및 자동화를 가능하게 하는 혁신적인 접근 방식으로 떠오르고 있습니다. 이러한 시스템은 정밀한 약물 투여가 가능할 뿐만 아니라, 특정 부위에 도달해 제어된 방출이 이루어지도록 설계된 약물 운반체 개발을 지원합니다.
이 리뷰에서는 약물 전달 분야에서 마이크로플루이딕스 기술이 지속적으로 발전함에 따라 지질 기반 및 고분자 기반 운반체 제조는 물론, 효율적이고 최소 침습적인 약물 전달을 위한 마이크로니들(microneedle) 시스템에 어떻게 활용되고 있는지를 논의할 예정입니다. 또한, 약물 결정화 분야에서 마이크로플루이딕 플랫폼이 수행하는 역할을 살펴볼 것이며, 이는 약물 제제의 구조 분석 및 최적화에 기여하고 있습니다. 이러한 발전은 약물 전달 시스템의 개선에 핵심적인 역할을 합니다.
목차:
약물 전달에서 마이크로플루이딕스는 기존 방법과 어떻게 다른가요?
경구 투여, 주사, 흡입과 같은 전통적인 약물 전달 방식은 오랫동안 리포좀 및 고분자 나노입자와 같은 약물 운반체 제조를 위해 기존 기술에 의존해 왔습니다.¹’² 이러한 시스템들은 약물의 용해도, 안정성, 표적 전달 능력을 향상시키는 것을 목표로 하지만, 그 제조 과정은 복잡하고 대량 생산이 어렵거나 정밀도 및 재현성이 떨어지는 경우가 많습니다. 낮은 생체 분포 특성과 생물학적 장벽이라는 문제점까지 더해지면서 많은 치료 물질들의 효과가 제한되고 있습니다. [3]
헬스케어 분야에서 마이크로플루이딕(microfluidics) 기술은 보다 효율적이고 통제된 약물 전달 시스템으로의 전환을 가능하게 하는 유망한 기술입니다. 마이크로미터 단위에서 유체를 조절할 수 있는 능력 덕분에, 마이크로플루이딕스는 고급 약물 운반체의 정밀하고 대량 생산이 가능하며 재현성 있게 제작할 수 있도록 해줍니다(그림 1). [4,6]
이 리뷰에서는 마이크로플루이딕스를 활용한 정밀 약물 전달 기술의 최근 발전을 다루며, 다음과 같은 세 가지 주요 영역으로 구성됩니다:
(a) 마이크로플루이딕 플랫폼을 통해 지질 기반 및 고분자 나노입자를 포함한 약물 운반체 제작;
(b) 최소 침습적 적용을 위한 마이크로니들 기술과 마이크로플루이딕스 통합;
(c) 결정화 기술 및 체외 전달 메커니즘 연구용 플랫폼 개발 등, 나노의학 및 약물 연구 분야에서의 마이크로플루이딕스의 폭넓은 응용.
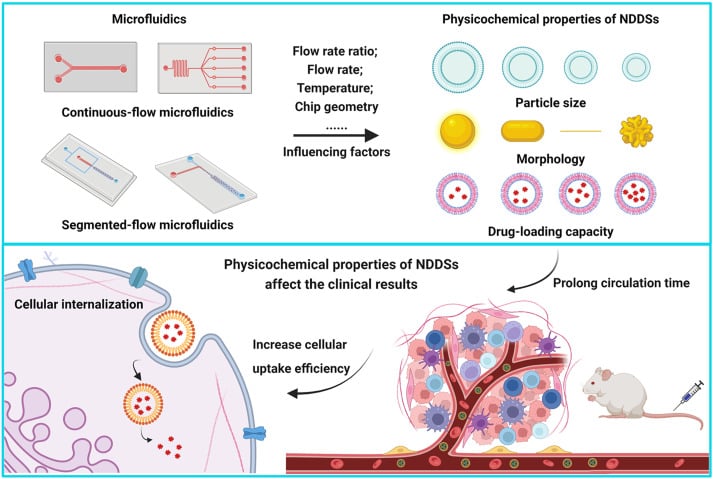
(출처: Zhang, H. 외; Acta Pharmaceutica Sinica B 2023, 13 (8), 3277–3299).
마이크로플루이딕 기술은 어떻게 약물 전달 입자 합성을 개선하나요?
1. 지질 나노입자 합성을 위한 마이크로플루이딕 기술:
지질 기반 나노입자(Lipid-based nanoparticles, LNPs)는 생체적합성, 다양한 치료 물질을 포장할 수 있는 능력, 그리고 제어된 약물 방출을 가능하게 하는 점에서 유망한 약물 전달 시스템입니다. 특히 LNPs는 소수성 약물, 핵산 및 기타 민감한 분자 전달에 매우 유용합니다. 다음으로 약물 전달을 위한 LNPs 합성에 사용되는 마이크로플루이딕 기술을 소개합니다. [7]
- 마이크로플루이딕 유체 집속법 (Microfluidic Hydrodynamic Focusing, MHF):
이 기술은 용매에 녹아 있는 지질의 중심 유로를 두고, 양쪽을 완충액의 유동층으로 둘러싸는 구조를 사용합니다. 지질 용액이 얇은 흐름으로 모이게 되면 빠른 확산이 일어나며, 이는 나노입자의 자가 조립(self-assembly)을 유도합니다(그림 2-A). 유량비(flow rate ratio, FRR)는 집속 정도를 결정하며, 이를 통해 입자의 특성을 정밀하게 조절할 수 있습니다. MHF는 스트림 구성(configuration)을 조정함으로써 친수성 약물의 동시 포집 또한 가능합니다. [8,9]
- 혼합 효율 향상을 위한 무질서 대류 혼합기 (Chaotic Advection Mixers):
이러한 시스템은 격자 무늬(herringbone pattern)나 뱀 모양 경로 같은 특수 설계된 마이크로채널을 포함하며, 층류(laminar flow)를 교란시켜 유체층을 늘리고 접는 과정을 통해 빠른 혼합을 유도합니다(그림 2-B). 이러한 방식은 용매와 지질이 신속하게 혼합되어 균일한 나노입자 형성을 촉진합니다. 무질서 대류 혼합기는 빠른 혼합과 연속 흐름 작동의 장점을 결합합니다. [10,12]. 이 방법을 활용한 리포솜 제조의 전반적인 잠재력을 탐색해 보세요.
- 소용돌이 집속법 (Vortex Focusing):
MHF와 혼합 효율 증대 기술의 하이브리드 형태로, 지질 용액이 축방향으로 주입되고 완충액이 접선 방향으로 들어가는 원추형 챔버를 이용합니다(그림 2-C). 발생하는 나선형 유동은 지질 유로를 집속하면서 동시에 회전 운동을 통해 혼합을 강화하여 단일 공정에서 효율적인 나노입자 생성을 가능하게 합니다. [13,14]
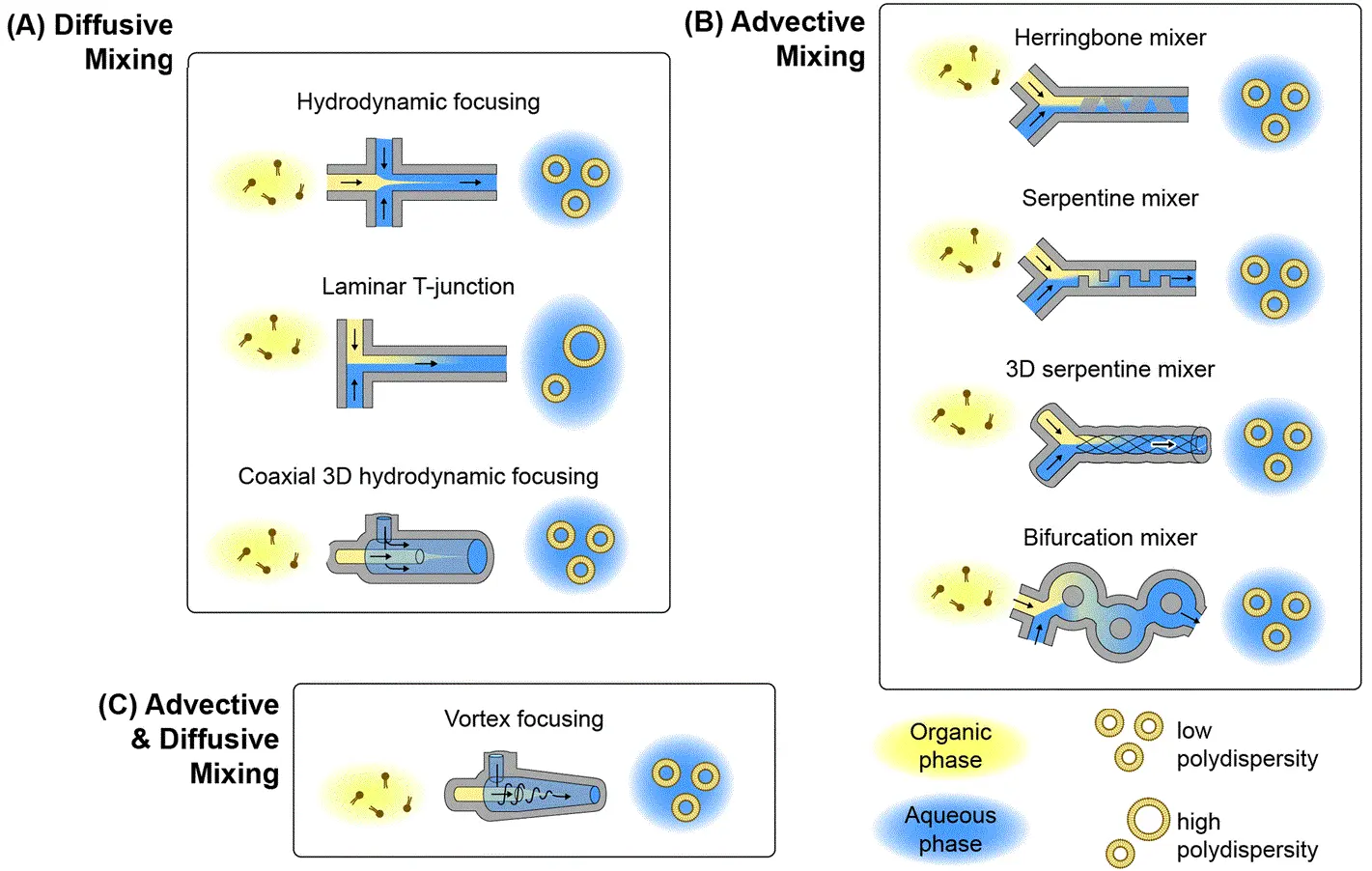
(출처: Mehraji, S. 등; Lab Chip 2024, 24 (5), 1154–1174).
2. 고분자 나노입자의 마이크로플루이딕 합성:
고분자 나노입자(Polymeric nanoparticles, PNPs)는 다양한 구조적 유연성과 다양한 치료 물질을 포장할 수 있는 능력 덕분에 약물 전달 분야에서 점점 더 널리 사용되고 있습니다. 이에는 친수성 및 소수성 분자뿐 아니라 핵산과 단백질도 포함됩니다. 지질 기반 나노입자가 주로 지질의 자기 조립 구조를 기반으로 하는 반면, PNPs는 폴리(락트산-코-글리콜산)(PLGA), 폴리카프로락톤(PCL) 등과 같은 생분해성 또는 생체적합 고분자 물질로 구성됩니다. 이러한 고분자들은 매트릭스 형태의 나노구체(nanosphere)나 코어-쉘(core-shell) 구조의 나노캡슐(nanocapsule) 형태로 형성될 수 있으며, 다양한 생리활성 물질을 포장하는 데 유연성을 제공합니다. [9,15]
PNPs의 마이크로플루이딕 합성은 입자 크기, 입도 분포, 포집 효율 등 면에서 LNP 제조와 유사한 특징을 가지며, 매우 정밀한 제어가 가능합니다(그림 3). PNPs 합성을 위한 기술로는 유체 집속법(hydrodynamic focusing), 나노침전법(nanoprecipitation), 동축 흐름 시스템(coaxial flow system) 등이 있으며, 이들 모두는 LNP 합성에도 사용되는 공통된 방법들입니다. 주요 차이점은 사용되는 재료 조성과 용매 시스템에 있습니다. [2,5,9,15,16 ]
(출처: Begines, B. 등; Nanomaterials 2020, 10 (7), 1403).
3. 드롭렛 기반 마이크로입자의 마이크로플루이딕 제조:
생체고분자(biopolymer)로 제작된 마이크로입자는 지속적인 약물 전달, 세포 치료, 생체 의학적 임플란트 분야에서 중요한 플랫폼으로 떠오르고 있습니다. 기존의 배치식(batch) 제조 방법은 종종 입자 크기 조절이 어렵고 재현성이 낮다는 문제가 있습니다. 마이크로플루이딕 기술은 균일한 마이크로입자를 정밀하게 제작할 수 있어 고품질의 약물 전달 시스템 구현에 기여하고 있습니다.
이 기술은 미세채널(microchannel) 내에서 드롭렛(droplet)을 생성하는 방식으로 이루어지며, 여기서 고분자 용액은 서로 혼합되지 않는 운반 유체(carrier fluid) 속에 포장됩니다. 이후 이러한 드롭렛은 가교결합(crosslinking), 용매 증발(solvent evaporation), 중합(polymerization) 등의 과정을 통해 경화됩니다. 미세채널의 기하학적 구조와 유동 조건은 드롭렛 크기와 생성 빈도를 정밀하게 조절할 수 있도록 세심하게 조정될 수 있습니다. [5,9,17,19]
이러한 방법들은 정밀도, 재현성, 다양한 약물 및 재료와의 호환성을 갖추고 있어 차세대 치료 시스템에 적합한 선택지로 각광받고 있습니다.
표 1: 마이크로플루이딕 기술을 이용한 약물 포장 사례 (Parra Saldivar 등; Frontiers in Bioscience 2018, 10 (1), 74–91 참고하여 재구성함).
| 사용된 재료 | 채널 기하학 구조 | 운반체 물질 | 약물 | 적용 분야 | 참고문헌 |
|---|---|---|---|---|---|
| 유리 | 공류(co-flow) | Human serum albumin, poly(lactic acid) | Doxorubicin | 간암 치료 | 20 |
| PEEK 및 실리카 튜브 | T-접합 | Poly(methyl acrylate), poly(acrylamide) | Ketoprofen, ranitidine | 위 점막 자극 효과 억제 | 21 |
| 실리콘 | 흐름 집속 | PLGA | Ciclosporin | 면역억제 요법 | 22 |
| PDMS | 헤링본 형태의 공류 | Liposomes | Propofol | 마취제 | 23 |
| 큐 Quartz 칩 | 흐름 집속 | Hyaluronic acid, ethylenediamine | Dexamethasone | 중간엽 줄기세포의 세포 분화 | 24 |
| 유리 | 공류 및 흐름 집속 | Polycaprolactone, poly(vinyl alcohol), poly(ethylene glycol) | Bovine serum albumin | 단백질 치료 | 25 |
| PDMS | T-접합 | Poly(ethylene glycol) diacrylate | 5-fluorouracil | 암 치료 | 26 |
| PMMA | V-접합 | Poly(methylsilsesquioxane) | Itraconazole | 항진균제 (감염 치 | 27 |
마이크로플루이딕 기반 마이크로니들 시스템: 운반체 없는 약물 전달
마이크로플루이딕 기술은 운반체 없이 약물을 직접 전달하는 시스템의 발전을 가능하게 합니다. 마이크로플루이딕 플랫폼이 제공하는 정밀성과 제어력을 활용함으로써, 약물을 표적 부위에 직접 전달할 수 있어 기존의 약물 운반체 사용이 최소화됩니다. 이는 생체이용률(bioavailability) 향상과 표적 방출(targeted release)을 실현하는 더 효율적인 약물 전달 시스템을 구축합니다. 이러한 접근법에서 가장 유망한 요소 중 하나가 바로 마이크로니들(microneedles)로, 미세유체 장치에 고도로 통합되어 치료 물질의 전달을 최적화합니다. [2,28,29]
마이크로니들(MNs):
마이크로니들은 피부나 다른 조직을 관통하여 표적 약물 전달을 위한 소형 정밀 구조인 마이크로미터 크기의 바늘 배열을 이용하는 장치입니다. 이러한 마이크로니들은 전통적인 주사 및 경구 투여 방식 대신 무통(painless), 최소 침습(minimally invasive) 방식으로 약물을 투여할 수 있습니다. 마이크로플루이딕스가 제공하는 제어력은 약물의 국소적이고 조절 가능한 방출을 보장하며, 특히 소화관에서 분해될 수 있는 치료제의 생체이용률과 표적 효과를 개선하는 데 기여합니다.
마이크로니들의 종류 :
- 솔리드 마이크로니들 (Solid MNs):
피부에 미세 채널을 생성한 후 약물을 국소적으로 도포하여 피부를 통해 수동 확산시키는 방식입니다. 일반적으로 실리콘, 금속, 고분자 재료로 제작됩니다.³⁰ - 용해형 마이크로니들 (Dissolving MNs):
피부에 삽입되면 생분해되는 재료로 만들어져 약물을 직접 표적 조직에 방출합니다. 사용되는 재료로는 폴리비닐 알코올(PVA), 폴리비닐피롤리돈(PVP), 폴리락트산(PLA) 등이 있습니다.[31] - 하이드로겔 마이크로니들 (Hydrogel MNs):
팽윤성 고분자 재료로 구성되며, 피부에 삽입되었을 때 하이드로겔이 팽창하면서 약물을 방출합니다. 사용되는 재료에는 폴리에틸렌 글리콜(PEG), 폴리아크릴아마이드(PAAm), 키틴(chitosan) 등이 포함됩니다.[32] - 중공 마이크로니들 (Hollow MNs):
중앙이 뚫린 구조로 설계되어 바늘을 통해 체내로 약물을 직접 주입할 수 있도록 해줍니다. 일반적으로 유리, 실리콘, 금속, 고분자 재료로 제작됩니다.[33,34]
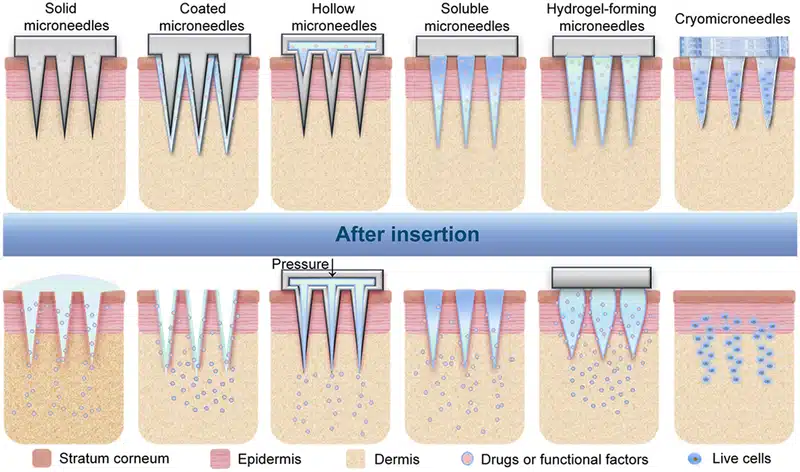
(출처: Zhang, Y. 등; Exploration 2023, 3 (1), 20210170)
약물 전달 평가를 위한 체외 모델
기존의 체외(in vitro) 모델과 인간 생리학의 복잡성 사이를 좁히기 위해, 오간온어칩(Organ-on-a-chip, OOC) 플랫폼이 약물 전달 시스템 평가에 있어 강력한 도구로 부상했습니다. 이러한 모델은 동적인 인체 조직의 구조와 기능을 매우 정밀하게 재현하며, 약물의 이동, 흡수, 치료 반응에 대한 귀중한 정보를 제공합니다. 따라서 마이크로플루이딕스를 활용한 약물 전달 기술은 나노운반체가 생물학적 장벽을 어떻게 통과하는지를 연구하는 데 각광받고 있습니다. [35,36]
약물 운반체가 체내에 들어가면 표적 부위까지 가는 길은 여러 주요 생리적 장벽에 의해 방해를 받습니다. 이러한 장애물을 정확하게 모델링하고 이해하는 것은 안전하고 효과적인 약물 전달 시스템 개발에 필수적입니다. 마이크로플루이딕 OOC 플랫폼은 연구자가 이러한 장벽을 실시간으로 시뮬레이션하고 분석할 수 있는 고도로 제어된 환경을 제공합니다.
주요 생물학적 장벽들 :
- 혈뇌장벽(Blood–Brain Barrier, BBB):
대부분의 치료제가 뇌에 도달하는 것을 차단하는 엄격히 조절된 인터페이스입니다. 마이크로플루이딕 BBB-on-a-chip 모델은 제어된 전단 흐름 하에서 내피세포, 아교세포, 주세포(pericytes)를 공배양하여 인간 BBB의 선택적 투과성과 밀접 접합(tight junction) 특성을 모방합니다. 이 시스템은 뇌 표적 약물 전달 시스템 평가에 매우 중요합니다. [37]
- 점막 확산 장벽(Mucosal Diffusion Barrier):
위장관, 호흡기, 생식기 등에 존재하는 두꺼운 점액층은 이물질을 포착하거나 배제하는 역할을 합니다. 마이크로플루이딕 모델은 점액의 점성도와 분비 역학을 재현하여 경구 및 흡입 약물 전달에서 나노입자의 확산, 침투, 유지 특성을 실시간으로 관찰할 수 있습니다. [38]
- 세포 투과 장벽(Cellular Permeability Barrier):
밀접 접합을 가진 상피 또는 내피 단일 세포층으로 구성되며, 세포 내(transcellular) 및 세포 간(paracellular) 수송을 조절합니다. 칩 기반 시스템은 세포 구조와 기계적 자극을 시뮬레이션하여 나노입자의 흡수, 수용체 매개 수송, 장벽 조절 등을 연구할 수 있습니다. [39] - 생화학적 장벽(Biochemical Barrier):
특히 장과 리소좀 환경에서는 효소와 pH 변화가 약물을 분해하거나 비활성화시킬 수 있습니다. 마이크로플루이딕 생화학 모델은 이러한 조건을 시뮬레이션하여 생리적으로 관련된 스트레스 조건 하에서 나노운반체의 안정성과 보호 효과를 평가할 수 있습니다.[2]
이러한 생물학적 장벽들을 마이크로플루이딕 오가논-온-어-칩 플랫폼에 통합함으로써, 보다 예측 가능하고 인간 생리학에 근접한 사전 임상 평가가 가능해집니다.
예를 들어, 장-온-칩(gut-on-a-chip) , 혈관-온-칩(vessel-on-a-chip) , 혈뇌장벽-온-칩(BBB-on-a-chip) 등의 장치는 마이크로플루이딕스를 활용한 정밀 약물 전달의 가능성을 입증하고 있습니다.
마이크로플루이딕스 기반 약물 전달 기술이 지속적으로 발전함에 따라, 이러한 플랫폼은 동물 모델 의존도를 줄이며, 나노의학 분야에서 약물의 약동학(pharmacokinetics), 약효학(pharmacodynamics), 치료 지수(therapeutic index)를 인간 생리학에 더욱 근접한 방식으로 평가하는 데 활용될 수 있습니다.
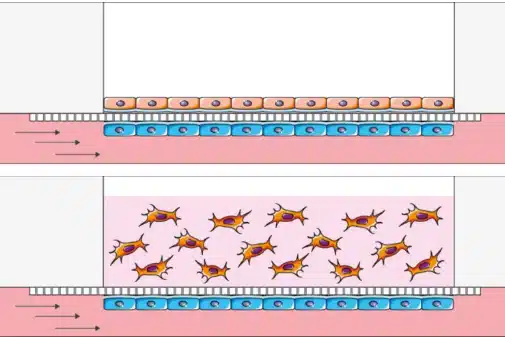
(출처: BeOnChip)
안구 약물 전달 응용 사례
안구 약물 전달 분야에서도 마이크로플루이딕 시스템을 활용해 동적인 안구 내 환경을 모방하는 사례가 증가하고 있습니다. 유량 제어 및 온도 조절 기능을 통합함으로써, 이러한 플랫폼은 안압 변동 및 안구 움직임 같은 생리 조건을 시뮬레이션할 수 있습니다. 이를 통해 이러한 변수들이 약물 제거 및 유지에 미치는 영향을 정밀하게 평가할 수 있습니다. 여러 체외 모델에서 자동 센싱과 유량 동기화 기술을 결합하면 제제 스크리닝의 재현성과 처리량을 향상시켜, 안구 내 약물 전달을 위한 보다 예측 가능하고 확장 가능한 테스트를 지원합니다.[40]
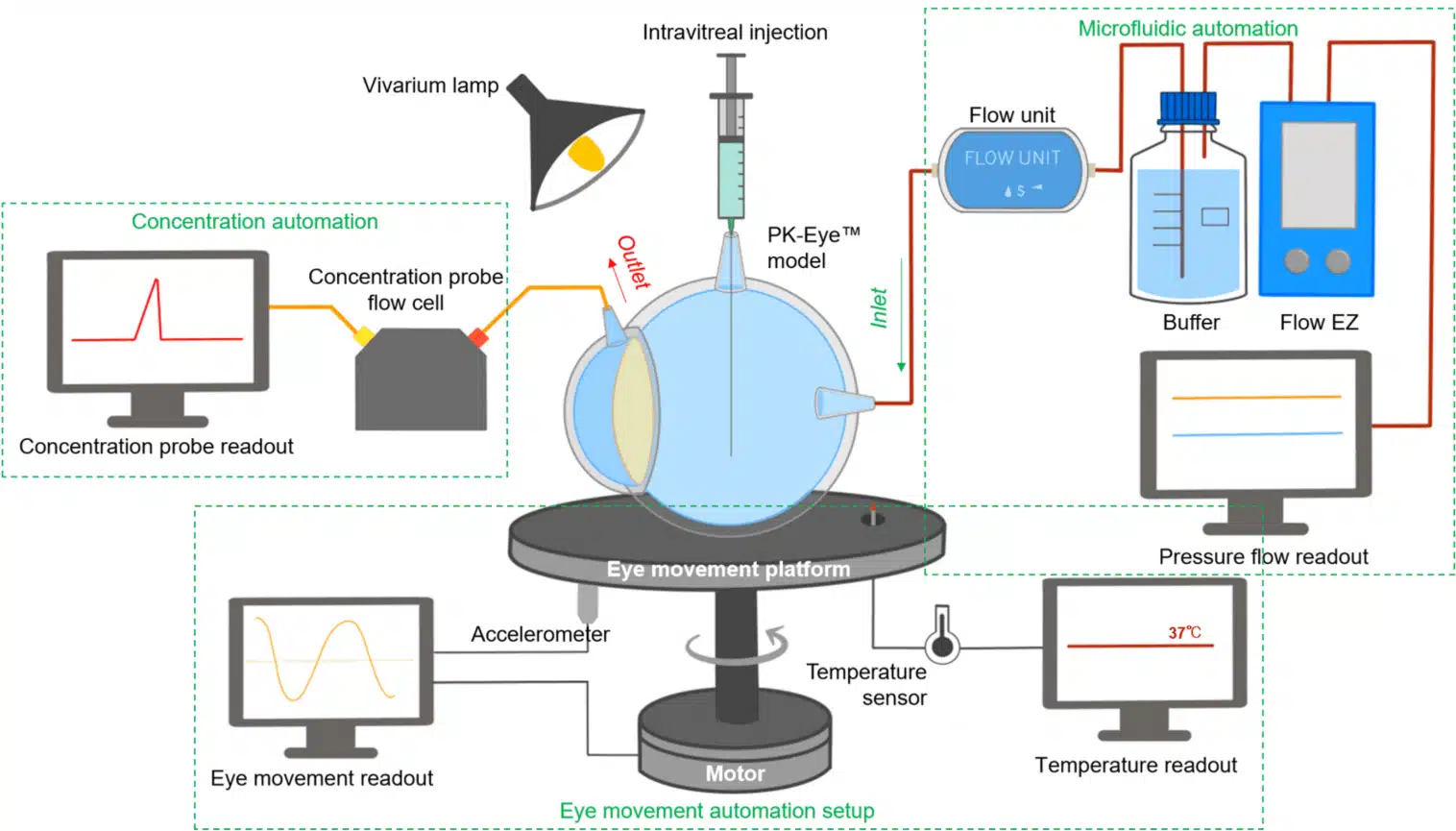
그림 7: 안구 약물 전달을 위한 체외 마이크로플루이딕 모니터링 플랫폼
(출처: Awwad, S. 등; Pharmaceutics 2023, 15 (5), 1444)
제약 연구에서의 마이크로플루이딕스 기반 약물 및 단백질 결정화
단백질 결정화는 신약 개발에서 핵심적인 과정인데, 마이크로플루이딕 시스템은 이를 혁신적으로 개선하고 있습니다. 기존에는 많은 양의 샘플이 필요했지만, 마이크로플루이딕 플랫폼은 극소량의 단백질과 시약만으로도 결정화 조건을 스크리닝할 수 있게 해줍니다. pH, 온도, 염 농도 등 다양한 조건을 시뮬레이션함으로써, 보다 빠르고 효율적인 결정화가 가능해졌습니다.
최근에는 원심력 기반 마이크로플루이딕 장치나 준접촉식 분주 방법(semi-contact dispensing) 같은 혁신 기술들이 고속 스크리닝과 정밀도 향상에 기여하면서 비용을 절감하고 신약 개발 속도를 가속화하고 있습니다. 이러한 발전은 구조 분석을 위한 고품질 단백질 결정 생산에 중요한 역할을 하며, 보다 표적화된 약물 전달에도 기여합니다.[41,43]
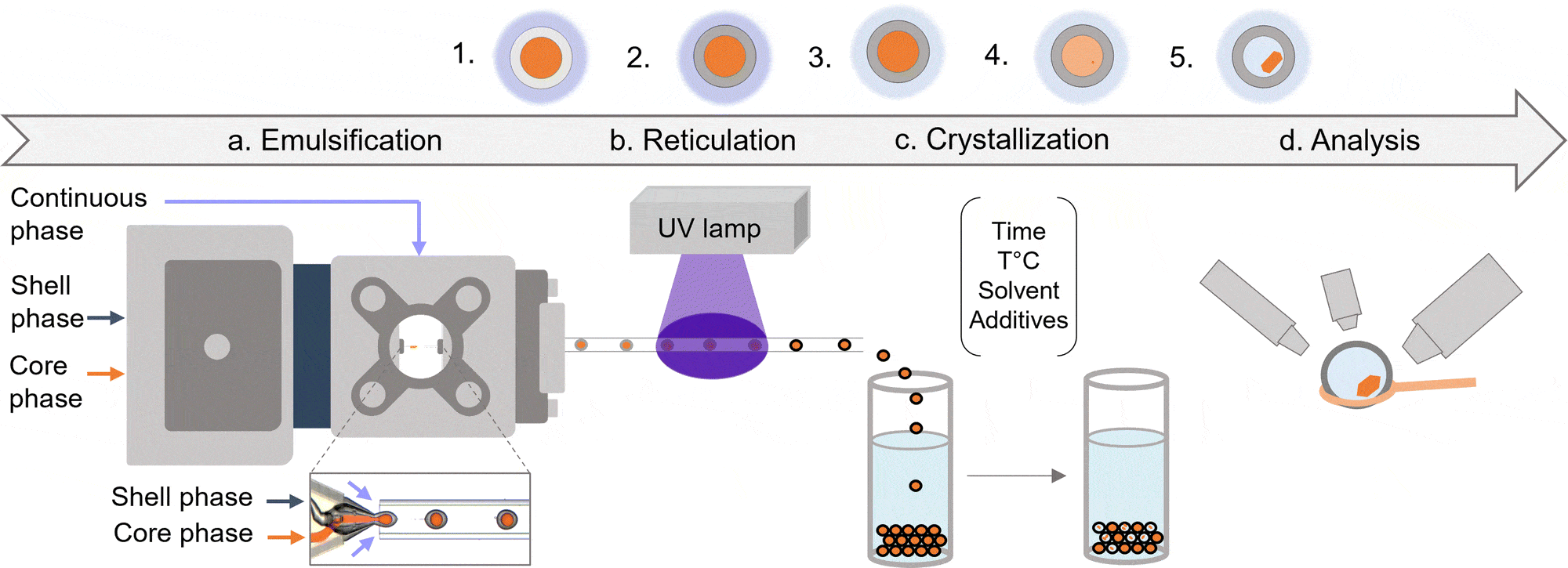

그림 8: (좌측) 초기 드롭렛에서 결정화 과정의 개념도, (우측) 마이크로캡슐 내 리소자임 결정화
(출처: Mettler, M. 등; Chemical Communications , 59, 12739–12742 (2023))
결론
본 리뷰에서는 마이크로플루이딕스 기술이 약물 전달 시스템의 생체이용률, 약물 효율성, 나노입자 성능을 어떻게 향상시키는지 살펴보았습니다. 기술적 진보에도 불구하고, 임상 적용을 위한 규모 확대(scale-up), 병렬화(parallelization) 개선, 그리고 제작 과정의 단순화라는 과제도 남아 있습니다. 그러나 마이크로플루이딕스와 오가논-온-어-칩 기술의 통합은 보다 정확한 사전 임상 테스트 및 개인 맞춤형 의학(personalized medicine) 구현에 유망한 해결책을 제시합니다. 지속적인 융합 연구와 협업을 통해 마이크로플루이딕스는 약물 전달 및 치료 분야에 혁신을 가져올 잠재력을 가지고 있습니다.
👉 당신의 약물 전달 프로세스를 개선하고 싶으신가요?
전문가에게 문의하거나, 마이크로플루이딕 압력 제어 시스템에 대해 자세히 알아보세요.
