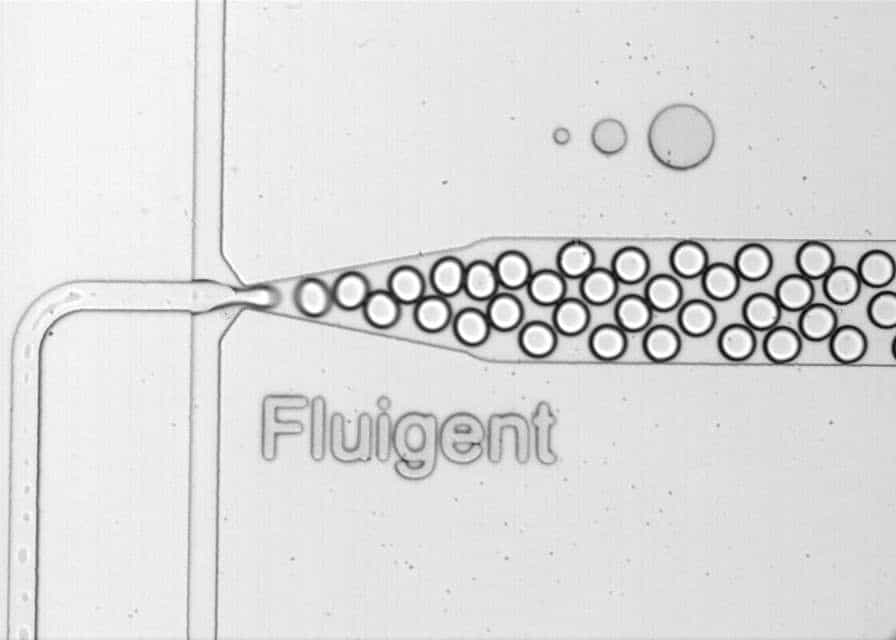
신뢰성 있는 드롭렛 생성을 위한 10가지 팁
드롭렛 기반 마이크로유체 기술은 약물 개발, 진단 및 신소재 합성 등 다양한 분야에서 정밀한 액체 제어를 요구합니다. 본 가이드는 일상적인 실험에서 드롭렛 또는 입자의 안정성과 단분산성(monodispersity)을 향상시키기 위한 신뢰성 있는 드롭렛 생성을 위한 10가지 최선의 실무 팁(best practices)을 제공합니다.
서론: 드롭렛 기반 마이크로유체 기술 마스터하기
드롭렛 기반 마이크로유체 기술은 서로 섞이지 않는 유체 흐름을 이용해 소량의 개별 액적을 생성하고 조작하는 다목적 마이크로유체 응용 분야입니다.[1] 이 기술은 약 20년 전 Thorsen 등에 의해 처음 탐구되었으며, 이후 H. Stone, D. Weitz, P. Tabeling 등의 연구자들에 의해 더욱 발전되었습니다. 이 기술은 크기와 형태가 균일한 드롭렛을 일관되게 생성할 수 있어, 기존의 스프레이 건조, 원심력 기반 드롭렛 생성, 초음파 분무 또는 벌크 혼합과 같은 전통적 방법보다 큰 장점을 제공합니다.[2]
균일한 드롭렛을 대량으로 생성할 수 있고, 세포, 생체 물질 및 기타 재료를 드롭렛 내에 캡슐화할 수 있는 능력 덕분에, 드롭렛 마이크로유체 기술은 약물 개발, 효소 반응 동역학, 단일세포 시퀀싱(single-cell sequencing), 조합 합성(combinatorial synthesis) 등 다양한 분야에서 필수적인 기술로 자리잡았습니다. 또한 이 기술은 랩온어칩(lab-on-a-chip) 기술을 지원하여 개인 맞춤형 의료, 진단, 세포 배양, 조직 공학 및 약물 전달 분야의 발전에도 기여하고 있습니다.[3-7]
그러나 여전히 드롭렛의 안정성, 단분산성(monodispersity), 그리고 조작 과정에서 시료의 무결성(integrity) 유지와 관련된 과제들이 존재합니다. 본 가이드는 효율적인 드롭렛 생성을 도와드리고, 문제 해결 시간을 최소화하며, 드롭렛 형성을 개선할 수 있는 10가지 핵심 팁을 제공합니다.
1. 드롭렛 생성을 위한 적절한 마이크로유체 칩 설계 선택하기
마이크로유체 칩의 설계는 드롭렛 크기 제어와 간단한 드롭렛 생성에 있어 핵심적인 역할을 합니다. 다음은 일반적으로 사용되는 몇 가지 설계입니다(그림 1 참조):[8]
- 동축(coaxial) 구조: 연속상(continuous phase)이 분산상(dispersed phase)을 3차원적으로 둘러싸며, 균일한 드롭렛과 우수한 드롭렛 형성 제어를 제공합니다. 다만 제작이 복잡합니다.[9]
- 공류(co-flow) 구조: 분산상이 내부 모세관(capillary)을 따라 흐르며, 동축 구조보다 제작이 간단하면서도 드롭렛 크기 제어가 가능합니다.[10]
- 유동 집속(flow-focusing) 구조: 반대 방향에서 흐르는 유체가 좁은 수축부(constriction)에서 드롭렛을 분리(pinch-off)시켜 안정적인 드롭렛 형성을 가능하게 하나, 제작이 다소 복잡합니다.[11-12]
- 교차 유동(cross-flow) 구조: 두 상이 T자형 접합부(T-junction)에서 만나며, 낮은 유속과 균일한 드롭렛 생성에 적합하지만 다른 설계들에 비해 정밀도가 다소 떨어집니다.[2]
- 단계 유화(step-emulsification) 구조: 분산상이 채널 단면적이 급격히 증가하는 지점을 통과할 때 드롭렛이 형성되며, 고속 처리(high-throughput) 및 단분산 드롭렛 생성에 이상적입니다.[13]
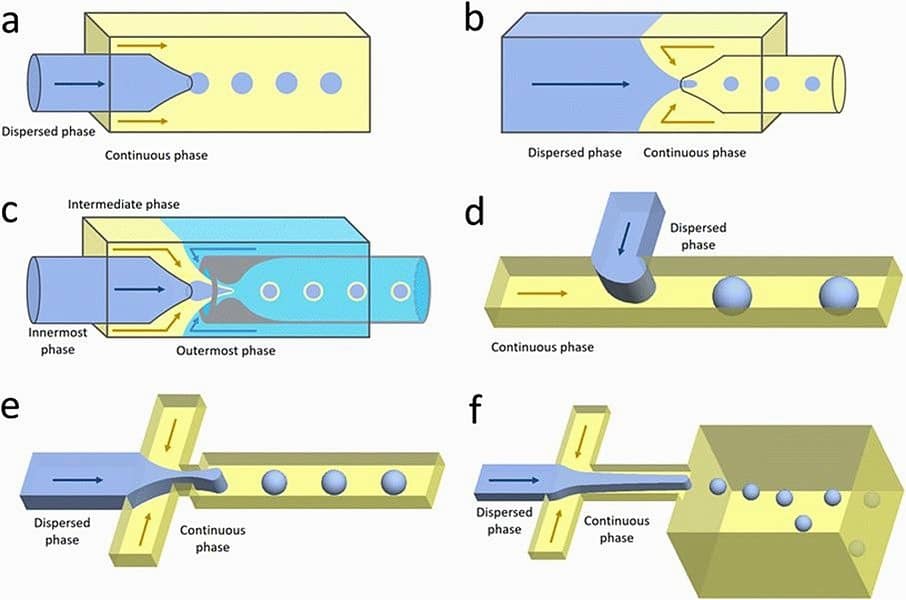
a) 모세관 공류(capillary co-flow),
b) 모세관 유동 집속(capillary flow-focusing),
c) 모세관 공류와 유동 집속의 결합형,
d) 교차 유동(cross-flow),
e) 평면 유동 집속(planar flow-focusing),
f) 단계 유화(step-emulsification).[8]
(Nan, L. 외, Lab. Chip 24, 1135–1153 (2024)에서 발췌)
적절한 구조를 선택하는 것은 요구되는 드롭렛의 균일성, 처리량(throughput), 그리고 제작 복잡도에 따라 달라집니다. 공류(co-flow)나 교차 유동(cross-flow)과 같은 간단한 설계는 제작이 용이하지만, 동축(coaxial)이나 단계 유화(step-emulsification)와 같은 보다 복잡한 설계는 더 나은 제어력과 정밀도를 제공합니다.

Secoya Technologies의 RayDrop 알아보기: 교환 가능한 노즐을 통해 공류와 유동 집속 구조를 결합하여 단일 에멀전(single emulsion)과 이중 에멀전(double emulsion) 사이를 실용적으로 전환할 수 있습니다.
2- 为微流控芯片选择合适材料
재료 선택은 마이크로유체 장치의 성능, 제작 복잡도 및 대량 생산 가능성(scalability)에 큰 영향을 미칩니다. 주요 재료는 다음 세 가지 범주로 분류할 수 있습니다:[14]
- 무기 재료 (유리 및 실리콘): 뛰어난 내화학성, 기계적 강성, 높은 광학 투명도를 제공합니다. 그러나 제작 비용이 높고, 포토리소그래피(photolithography) 및 습식 에칭(wet-etching) 기술이 필요해 제작이 까다롭습니다. 그럼에도 불구하고 유리 칩은 세척 후 재사용이 가능하다는 장점이 있습니다.[9]
- 엘라스토머 (PDMS): 저렴하고 제작이 쉬우며 우수한 유연성을 지닌 대안입니다. 일반적으로 소프트 리소그래피(soft lithography)를 통해 패터닝되며, 유리 또는 다른 PDMS 층과 접합할 수 있습니다. 그러나 PDMS는 유기 용매와의 호환성이 낮아 일부 응용 분야에서 사용이 제한됩니다. 또한 소수성 소분자(hydrophobic small molecules)를 흡착하는 경향이 있어, 생체 또는 화학 분석에서 분석물 농도를 낮추거나 의도치 않은 오염을 유발할 수 있습니다.[15]
- 열가소성 수지 (PMMA, PC, PS, PVC, COC): 사출 성형(injection molding) 또는 핫 엠보싱(hot embossing)을 통해 대량 생산이 가능합니다. 고처리량 생산에는 이상적이지만, 소량 제작 시에는 리소그래피보다 해상도가 낮은 미세 가공(micromachining)이 필요합니다. 일부 열가소성 수지 및 엘라스토머는 3D 프린팅도 가능하지만, 해상도는 기술에 따라 차이가 있습니다.[14,16]
최적의 재료는 사용 목적에 따라 달라집니다. 유리와 실리콘은 높은 정밀도를 제공하지만 비용이 높고, PDMS는 유연성과 제작 용이성을 제공하며, 열가소성 수지는 대량 생산에는 적합하지만 미세 구조에 대한 해상도가 낮을 수 있습니다.
표 1: 무기 재료, 엘라스토머 및 열가소성 수지의 특성[14]
(Elvira, K.S. 외, Lab. Chip 22, 859–875 (2022)에서 재구성)
| 속성(Property) | 무기 재료 (유리, 실리콘) | 엘라스토머 (PDMS) | 열가소성 수지 (PMMA, PTFE) |
|---|---|---|---|
| 화학적 호환성 (Chemical Compatibility) | 높음 | 보통 | 보통~양호 |
| 열 안정성 (Thermal Stability) | 높음 | 보통 | 가변적 (재료에 따라 다름) |
| 표면 친수성 (Surface Hydrophilicity) | 친수성 | 일반적으로 소수성 | 일반적으로 소수성 |
| 물리적 패터닝 방법 (Physical Patterning) | 레이저 가공, 미세 가공, 화학 에칭 | 주조(Casting), 3D 프린팅 | 미세 가공, 성형(Moulding), 레이저 가공, 3D 프린팅 |
| 제작 시간 (Fabrication Time) | 길음 (복잡한 공정 때문) | 중간 (주조 또는 3D 프린팅 방식에 따라 다름) | 중간 (공정 복잡도에 따라 다름) |
| 비용 (Cost) | 높음 (특수 장비 및 공정 필요) | 중간 (재료 자체는 비교적 저렴하나, 주조 및 3D 프린팅 비용은 상황에 따라 다름) | 중간 (재료 선택 및 공정 복잡도에 따라 달라짐) |
마이크로유체 칩을 선택하는 방법과 미세 가공(microfabrication) 공정을 자세히 알아보세요.
3- 젖음성(wetting) 및 표면 처리 제어하기
유체와 채널 표면 간의 상호작용은 어떤 유체가 연속상(continuous phase)이 되고, 어떤 유체가 분산상(dispersed phase)이 될지를 결정합니다. 마이크로유체 채널은 크기가 작고 표면적 대 부피 비율(surface area-to-volume ratio)이 매우 높기 때문에, 채널/유체 계면(interface)이 유체 거동에 지배적인 영향을 미칩니다. 이러한 현상은 재료 선택 또는 표면 개질(surface modification) 기술을 통해 조절할 수 있습니다.
- 재료 선택: 적절한 표면 특성을 가진 재료를 선택함으로써 올바른 젖음성(wetting)을 확보할 수 있습니다(표 1 참조). 예를 들어, 친수성(hydrophilic) 표면은 수용성 유체(aqueous fluids)를 우선적으로 젖게 하여 oil-in-water(O/W) 드롭렛 형성을 촉진합니다. 반면 소수성(hydrophobic) 표면은 water-in-oil(W/O) 드롭렛 생성에 이상적입니다. 접촉각(contact angle)은 드롭렛 유형을 결정하는 중요한 요소이며, 특정 임계 접촉각(critical contact angle)을 기준으로 W/O 또는 O/W 드롭렛이 형성됩니다.[14, 16–20]
- 표면 개질: 재료의 고유 표면 특성이 목적에 부합하지 않을 경우, 표면 개질이 필요합니다. 플라즈마 처리(plasma treatment), 산화(oxidation), 실란화(silanization)와 같은 기술을 통해 표면 특성을 조정할 수 있습니다. 예를 들어, 유리는 O/W 및 W/O 드롭렛 모두를 위해 개질이 가능하지만, PDMS는 장기간 안정적인 드롭렛 생성을 위해 종종 표면 처리가 필요합니다.[21–23]
따라서 마이크로유체 장치에서 안정적이고 제어된 드롭렛 형성을 달성하려면 적절한 재료 선택과 플라즈마 처리, 산화, 실란화와 같은 표면 처리 기술이 필수적입니다.
4- 드롭렛 안정화를 위한 계면활성제(surfactant) 사용
계면활성제(또는 유화제, emulsifier)는 양친매성(amphiphilic) 분자로, 유체-유체 계면을 안정화하며 채널 표면을 일시적으로 개질할 수 있습니다. 계면활성제를 변경함으로써 추가적인 표면 처리 없이도 동일한 장치 내에서 water-in-oil(W/O) 및 oil-in-water(O/W) 드롭렛을 모두 생성할 수 있습니다.[24]
- 계면활성제의 기능: 일반적인 계면활성제로는 음이온성 계면활성제인 SDS(sodium dodecyl sulfate)와 비이온성 계면활성제인 Span 80, Tween 20, PEG(polyethylene glycol) 등이 있습니다. 이러한 계면활성제들은 표면 화학을 일시적으로 변화시켜 드롭렛을 안정화합니다(표 2 참조).[25]
- 계면활성제의 첨가 위치: 계면활성제는 분산상 또는 연속상 어느 쪽에도 첨가할 수 있습니다. 연속상에 첨가된 계면활성제는 채널/유체 계면으로 이동하여 표면을 코팅합니다. 일반적으로 분산상을 주입하기 전에 연속상을 먼저 흘려보내 장치를 프라이밍(prime)하는 방식으로 사용됩니다.[25,26]
계면활성제는 드롭렛을 안정화하고 채널 표면을 일시적으로 개질함으로써 드롭렛 형성을 정밀하게 제어할 수 있게 해줍니다.
표 2: 계면활성제 종류 및 특성 요약[27,28]
| 종류 (Type) | 특성 (Characteristics) | 예시 (Examples) |
|---|---|---|
| 음이온성 (Anionic) | 친수성 부분이 강한 음전하를 띱니다. 자극성과 급성 독성 가능성이 높습니다. | 소듐 라우릴 설페이트 (SLS) 소듐 도데실 설페이트 (SDS) |
| 양이온성 (Cationic) | 친수성 부분이 강한 양전하를 띱니다. 주로 화장품 제품에 사용됩니다. | 스테아르알코늄 (Stearalkonium) 벤잘코늄 (Benzalkonium) 세틸트리메틸암모늄 브로마이드 (CTAB) 등 트리메틸 암모늄 계열 |
| 양쪽성 (Amphoteric) | 음전하와 양전하를 모두 가질 수 있습니다. 최종 전하는 pH에 따라 달라집니다. 자극이 적고 순합니다. | 하이드록시설테인 (Hydroxysultaines) 코코 벤테인 (Coco Betaine) 라우릴 벤테인 (Lauryl Betaine) |
| 비이온성 (Non-ionic) | 친수성 부분이 전하를 띠지 않습니다. 약물 전달 시스템, 생물학적 검사, 식품 유화 등 다양한 응용 분야에 자주 사용됩니다. | PEG (폴리에틸렌 글리콜) 소르비탄 (Sorbitans) 폴리소르베이트 (Polysorbates) 트윈(Tweens) 및 스팬(Spans) |
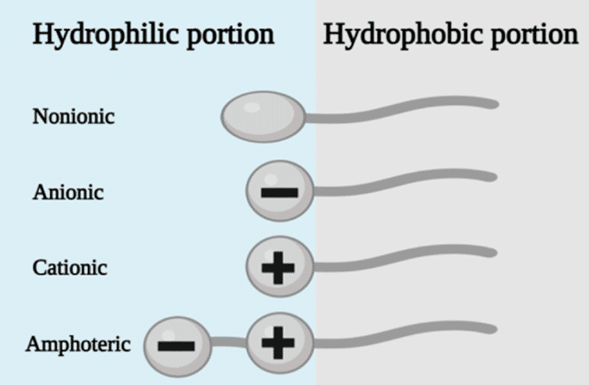
(Perelomov, L. 외, Sustainability 16, 4804 (2024)에서 발췌)
5- 압력 제어기(pressure controller)로 드롭렛 안정성 향상하기
마이크로유체 실험에서 신뢰성 있는 드롭렛 생성을 위해서는 유속을 정밀하게 제어하는 것이 매우 중요합니다. 드롭렛의 크기와 단분산성(monodispersity)은 유속 제어의 정확도에 직접적으로 의존하므로, 반복 가능하고 신뢰할 수 있는 결과를 얻기 위해 정밀한 유동 제어가 필수적입니다. 적절한 유동 제어 방식을 선택하는 것은 드롭렛 품질에 큰 영향을 미칩니다.
- 주사기 펌프(Syringe Pumps): 기계적 작동 원리에 기반하며, 펄스 오류(pulse errors)를 유발하고 유속 제어에 한계가 있어 드롭렛 크기의 불일치를 초래합니다. 이로 인해 반복 가능한 반응기 체적(reproducible reactor volumes)을 확보하기 어렵습니다.
- 압력 기반 유동 제어기(Pressure-Based Flow Controllers): 고정밀 유속 제어, 빠른 응답 속도, 그리고 실시간 연속 유동 모니터링 기능을 제공합니다. 이를 통해 드롭렛 크기를 일정하게 유지하고, 주사기 펌프에서 발생하는 펄스 오류를 완전히 제거할 수 있습니다.
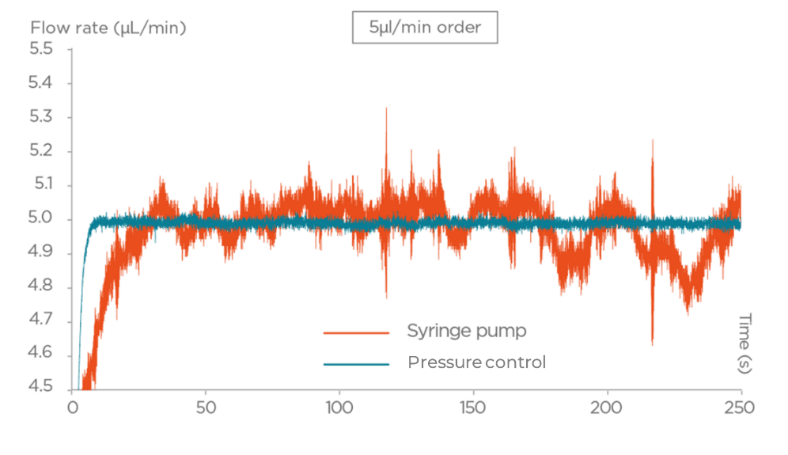
따라서 마이크로유체 시스템에서 보다 신뢰성 있고 일관된 드롭렛 생성을 위해서는 주사기 펌프보다 압력 기반 유동 제어기가 훨씬 우수한 대안입니다. 정밀한 제어와 펄스 없는(pulse-free) 작동 덕분에 실험 결과의 재현성이 크게 향상됩니다.
주사기 펌프와 비교한 압력 기반 제어기의 드롭렛 형성에 대한 영향에 대해 더 알아보세요.
6- 단분산성(monodispersity)을 위한 유속 비율 최적화
마이크로유체 드롭렛 생성 과정에서 관성력과 점성력 사이의 균형은 드롭렛의 크기와 일관성에 큰 영향을 미칩니다. 유체상의 물성(점도, 계면장력 등)과 유속과 같은 주요 파라미터는 드롭렛의 크기, 형태 및 구조에 직접적으로 작용합니다. 이 과정에서 모세관 수(Capillary number, Ca)는 핵심적인 무차원 수로, 유속 조절이 드롭렛 형성에 어떻게 영향을 미치는지를 결정합니다.[29,30]
- 상 유속과 캡슐 크기: 분산상(Q<sub>d</sub>)과 연속상(Q<sub>c</sub>)의 유속은 캡슐(또는 드롭렛) 크기와 직접적인 관계가 있습니다. Q<sub>d</sub>를 일정하게 유지하면서 Q<sub>c</sub>를 증가시키면 캡슐 크기가 감소합니다. 따라서 드롭렛 크기와 단분산성을 최적화하려면 Q<sub>d</sub>/Q<sub>c</sub> 비율을 정밀하게 조절하는 것이 매우 중요합니다.
이중 에멀전(Double Emulsion) 이중 에멀전 시스템에서는 유속 조절을 통해 캡슐 전체 크기뿐 아니라 쉘(shell)도 제어할 수 있습니다. 예를 들어, 이중 에멀전에서 쉘을 형성하는 중간상의 유속(Q<sub>d</sub>, 쉘 상 유속)을 증가시키면 캡슐 전체 크기는 거의 유지하면서 쉘 두께만 증가시킬 수 있습니다.
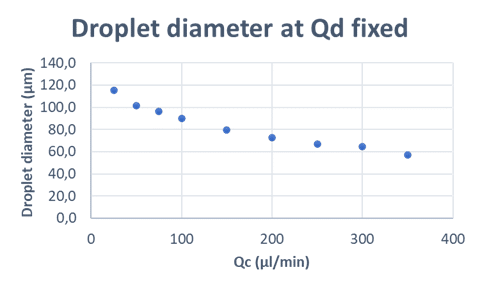
(Secoya Technologies가 개발한 RayDrop을 사용한 연구 결과)
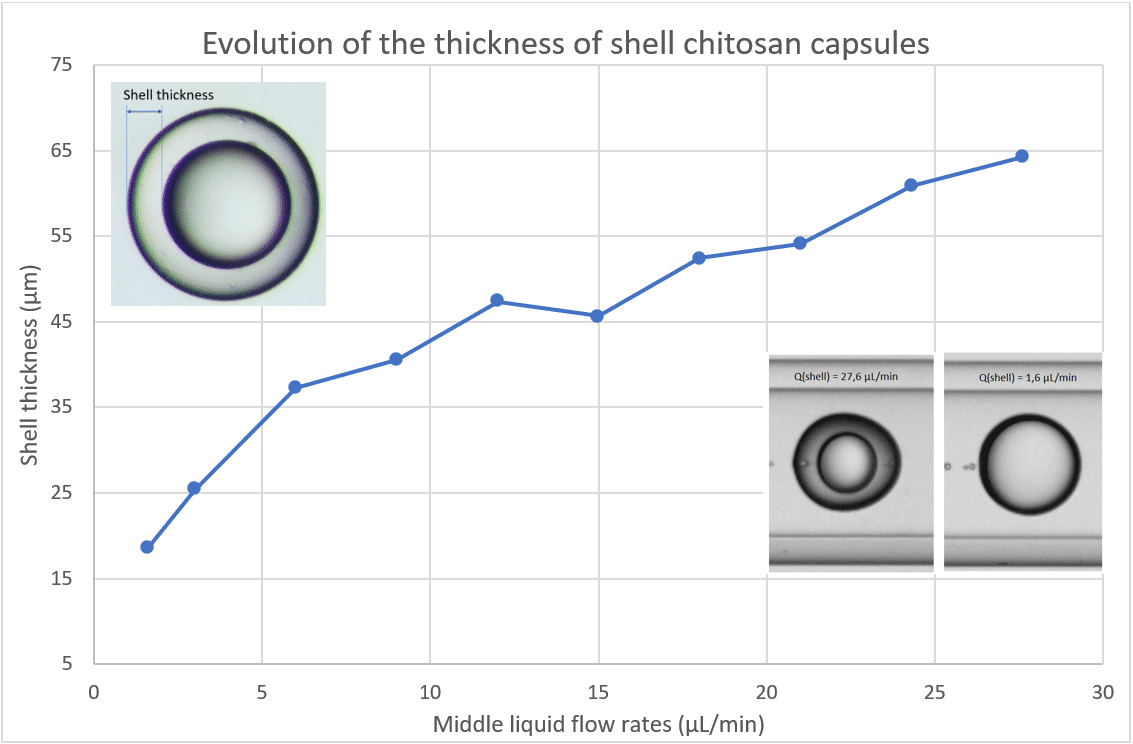
(Secoya Technologies가 개발한 RayDrop을 사용한 연구 결과)
결론적으로, 분산상과 연속상의 유속 비율을 최적화하는 것은 마이크로유체 시스템에서 균일한 드롭렛 크기와 높은 단분산성을 달성하는 핵심입니다. 이러한 비율을 정밀하게 조정함으로써 드롭렛 생성의 재현성과 정밀도를 크게 향상시킬 수 있습니다.
7- 실시간으로 문제를 모니터링하고 트러블슈팅하기
실시간 모니터링은 문제가 발생하는 즉시 이를 식별하고 해결하여 일관되고 정확한 실험 결과를 보장하는 데 필수적입니다. 예를 들어, 유속 실시간 제어 소프트웨어나 고속 카메라(high-speed cameras)와 같은 첨단 도구를 활용하면 핵심 파라미터를 지속적으로 추적하고 즉시 조정할 수 있습니다.
- 고속 카메라: 현미경과 통합된 고속 카메라는 드롭렛 형성 과정을 실시간으로 시각화할 수 있게 해줍니다. 이를 통해 드롭렛의 크기, 균일성은 물론, 채널 내 막힘(clogging)이나 불안정한 형성과 같은 잠재적 문제를 정밀하게 점검할 수 있습니다.
- Oxygen(Fluigent) 소프트웨어: 이 소프트웨어는 유속을 실시간으로 정밀하게 제어하고 모니터링할 수 있도록 지원합니다. 이를 통해 최적의 드롭렛 형성 조건을 유지하기 위한 빠른 조정이 가능하며, 압력, 유속, 시스템 성능에 대한 유의미한 데이터를 제공합니다.
마이크로유체 시스템에서 원활한 드롭렛 생성을 보장하려면 이러한 도구를 활용한 실시간 모니터링이 매우 중요합니다. 문제를 즉시 감지하고 대응함으로써 실험 전반에 걸쳐 결과의 일관성을 유지하고 시스템 성능을 최적화할 수 있습니다.
8- 안정적인 시스템을 위해 기포(bubble) 생성 방지하기
마이크로유체 시스템 내의 공기 기포는 유동 안정성을 방해하고 응답 시간을 저하시키며, 심한 경우 채널 막힘(clogging)을 유발하여 신뢰할 수 없는 결과를 초래할 수 있습니다. 이러한 기포는 용해된 기체, 누출(leaks), 또는 PDMS와 같은 재료의 투과성(permeability)으로 인해 장치 벽을 통해 공기가 확산되면서 발생할 수 있습니다. 따라서 원활하고 재현 가능한 실험을 위해 기포 형성을 방지하는 것이 매우 중요합니다.[31]
- 기포 형성의 원인 이해하기: 기포는 액체에 용해된 기체, 다공성 재료, 또는 시스템 충전 과정의 부주의로 인해 발생할 수 있습니다. 특히 PDMS와 같은 재료는 기체 투과성이 높아 시간이 지남에 따라 공기가 마이크로채널 내에 서서히 축적될 수 있습니다.
- 방지 전략: 사용 전 용액을 탈기(degassing) 처리하고, 기체 투과성이 낮은 재료를 선택하며, 친수성 표면 처리를 적용하면 기포 형성을 최소화할 수 있습니다. 또한 기포 트랩(bubble traps)이나 인라인 탈기기(inline degassers)를 도입하면 기포 없는 시스템을 더욱 확실히 보장할 수 있습니다.
마이크로유체 실험에서 기포를 방지하는 것은 안정적이고 신뢰성 있는 유동을 유지하는 데 필수적입니다. 용액 탈기, 적절한 재료 선택, 기포 트랩 사용을 통해 실험 중 발생할 수 있는 간섭을 크게 줄이고, 결과의 정확도를 향상시킬 수 있습니다.
9- 보조 도구를 통합하여 마이크로유체 시스템 최적화하기
실용적인 보조 도구를 마이크로유체 시스템에 통합하면 실험의 효율성, 정밀도 및 조작 용이성이 크게 향상됩니다. 정밀한 샘플 주입을 위한 유체 제어 밸브, 가교(crosslinking) 방법에 맞춘 시스템 구성, UV 가교 모듈 사용 등을 통해 드롭렛 마이크로유체 시스템에서 더 나은 캡슐화(encapsulation)와 안정성을 확보할 수 있습니다.
- 밸브를 활용한 손쉬운 유체 조작: Fluigent의 L-Switch와 같은 도구는 소량의 샘플을 정밀하게 주입할 수 있어, 줄기세포나 환자 유래 샘플과 같이 희귀하거나 민감한 세포를 다룰 때 특히 유용합니다. 이를 통해 제한된 샘플을 효율적으로 관리하고, 낭비를 줄이며, 실험 제어력을 높일 수 있습니다.
- 가교 방식에 맞춘 시스템 조정: 미세캡슐(microcapsule)의 쉘(shell)은 보호 및 기능 수행에 핵심적인 역할을 합니다. 캡슐화 공정에 따라 시스템을 적절히 조정하여 가교 방법과 일치시켜야 합니다.
- 물리적 경화(Physical Curing): 젤라틴, 알지네이트, 키토산과 같은 천연 고분자는 pH, 온도 또는 이온 강도의 변화에 따라 고화됩니다.[29,30,32]
- UV 가교(UV Crosslinking): 폴리아크릴아마이드, 폴리스티렌, 폴리(에틸렌 글리콜) 디아크릴레이트(PEGDA)와 같은 합성 고분자는 UV 광선 또는 열을 이용해 가교됩니다. 특히 PEGDA는 생의학적 응용 분야에서 조절 가능한 특성 덕분에 널리 사용됩니다.[33–35]
예를 들어, UV 가교 모듈을 도입하면 UV 광원에 노출시켜 고분자 가교를 유도할 수 있습니다. 조절 가능한 튜브 경사를 통해 드롭렛 수집이 간편해지고, 융합(coalescence)을 방지하여 우수한 캡슐화 결과를 얻을 수 있습니다.
유체 제어 밸브 통합, 다양한 가교 기술에 맞춘 시스템 조정, UV 가교 모듈 사용은 마이크로유체 실험의 정밀도, 재현성 및 효율성을 높이는 데 기여합니다. 이러한 도구들은 샘플 취급을 개선하고, 안정적인 캡슐화를 보장하며, 고품질의 미세캡슐을 생성할 수 있게 해줍니다.
당사의 드롭렛 생성 플랫폼을 확인해 보세요.
10- 청결한 설정 유지 및 적절한 세척 프로토콜 사용하기
마이크로유체 실험 중 채널 막힘, 오염, 유동 불안정을 방지하려면 항상 청결한 시스템을 유지하는 것이 필수적입니다. 적절한 여과, 표준화된 세척 프로토콜, 정기적인 유지보수는 원활한 작동과 재현 가능한 결과를 보장하는 핵심 요소입니다.
- 사전 여과 및 인라인 필터 사용: 마이크로유체 시스템에 용액을 주입하기 전 반드시 여과하여 채널을 막을 수 있는 입자를 제거해야 합니다. 또한 마이크로유체 회로에 인라인 필터(inline filters)를 설치하면 시스템 내로 유입되는 오염물질을 실시간으로 포집하여 실험 중 유동 차단을 방지할 수 있습니다.
- 세척 프로토콜 준수 및 막힘 해결: 사용하는 화학물질에 맞춰 세척 프로토콜을 조정하세요. 정기적인 세척은 화학적 잔여물 축적과 오염을 예방합니다. 만약 시스템이 막혔다면(특히 유리 칩의 경우), 유동 방향을 역전시켜 백플러시(backflush)를 수행하세요. 이 방법은 채널 손상 없이 막힘을 제거하고 정상적인 유동을 복원하는 데 효과적입니다.
마이크로유체 세척 액세서리의 예로, 당사의 플로우 유닛(flow unit) 세척 프로토콜을 참고하실 수 있습니다.
결론
정밀함은 마이크로유체 실험에서 신뢰성 있고 재현 가능하며 간편한 드롭렛 생성을 달성하는 열쇠입니다. 유속 최적화, 오염 방지, 적절한 도구 통합을 통해 실험 결과를 향상시키고 워크플로우를 효율화할 수 있습니다. 최상의 성능을 얻기 위해 실험 조건을 직접 조정하고 세밀하게 튜닝하는 것을 주저하지 마세요.
더 정밀한 제어를 원하신다면, Fluigent의 정밀 유속 제어 솔루션과 Secoya Technologies의 RayDrop 고급 드롭렛 생성 기술을 확인해 보세요. 당사의 솔루션은 귀하의 실험을 한 단계 더 높은 수준으로 끌어올릴 수 있습니다.
👉 액적 생성 공정을 개선하고 싶으신가요? 전문가에게 문의하거나, 마이크로플루이딕 압력 제어 시스템에 대해 자세히 알아보세요.
관련 전문 지식
참고문헌
1. Shi, N., Mohibullah, M. & Easley, C. J. Active Flow Control and Dynamic Analysis in Droplet Microfluidics. Annu. Rev. Anal. Chem. 14, 133–153 (2021).
2. Thorsen, T., Roberts, R. W., Arnold, F. H. & Quake, S. R. Dynamic Pattern Formation in a Vesicle-Generating Microfluidic Device. Phys. Rev. Lett. 86, 4163–4166 (2001).
3. Chiu, D. T. & Lorenz, R. M. Chemistry and Biology in Femtoliter and Picoliter Volume Droplets. Acc. Chem. Res. 42, 649–658 (2009).
4. Kim, S. C., Clark, I. C., Shahi, P. & Abate, A. R. Single-Cell RT-PCR in Microfluidic Droplets with Integrated Chemical Lysis. Anal. Chem. 90, 1273–1279 (2018).
5. Price, A. K., MacConnell, A. B. & Paegel, B. M. h ν SABR: Photochemical Dose–Response Bead Screening in Droplets. Anal. Chem. 88, 2904–2911 (2016).
6. Teh, S.-Y., Lin, R., Hung, L.-H. & Lee, A. P. Droplet microfluidics. Lab. Chip 8, 198 (2008).
7. Sjostrom, S. L., Joensson, H. N. & Svahn, H. A. Multiplex analysis of enzyme kinetics and inhibition by droplet microfluidics using picoinjectors. Lab. Chip 13, 1754 (2013).
8. Nan, L., Zhang, H., Weitz, D. A. & Shum, H. C. Development and future of droplet microfluidics. Lab. Chip 24, 1135–1153 (2024).
9. Utada, A. S. et al. Monodisperse Double Emulsions Generated from a Microcapillary Device. Science 308, 537–541 (2005).
10. Cramer, C., Fischer, P. & Windhab, E. J. Drop formation in a co-flowing ambient fluid. Chem. Eng. Sci. 59, 3045–3058 (2004).
11. Gañán-Calvo, A. M. & Gordillo, J. M. Perfectly Monodisperse Microbubbling by Capillary Flow Focusing. Phys. Rev. Lett. 87, 274501 (2001).
12. Anna, S. L., Bontoux, N. & Stone, H. A. Formation of dispersions using “flow focusing” in microchannels. Appl. Phys. Lett. 82, 364–366 (2003).
13. Li, Z., Leshansky, A. M., Pismen, L. M. & Tabeling, P. Step-emulsification in a microfluidic device. Lab. Chip 15, 1023–1031 (2015).
14. Elvira, K. S., Gielen, F., Tsai, S. S. H. & Nightingale, A. M. Materials and methods for droplet microfluidic device fabrication. Lab. Chip 22, 859–875 (2022).
15. Xia, Y. & Whitesides, G. M. Soft Lithography. Angew. Chem. Int. Ed. 37, 550–575 (1998).
16. Aghvami, S. A. et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sens. Actuators B Chem. 247, 940–949 (2017).
17. Wegrzyn, J. et al. Microfluidic architectures for efficient generation of chemistry gradations in droplets. Microfluid. Nanofluidics 14, 235–245 (2013).
18. Ren, K., Dai, W., Zhou, J., Su, J. & Wu, H. Whole-Teflon microfluidic chips. Proc. Natl. Acad. Sci. 108, 8162–8166 (2011).
19. Durán, I. R. & Laroche, G. Current trends, challenges, and perspectives of anti-fogging technology: Surface and material design, fabrication strategies, and beyond. Prog. Mater. Sci. 99, 106–186 (2019).
20. Arunachalam, S. & Mishra, H. Collective wetting transitions of submerged gas-entrapping microtextured surfaces. Droplet n/a, e135 (2024).
21. Salami, T. O. et al. Toward a better understanding of synthesis and processing of ceramic/self-assembled monolayer bilayer coatings. J. Electron. Mater. 34, 534–540 (2005).
22. Owen, M. J. & Smith, P. J. Plasma treatment of polydimethylsiloxane. J. Adhes. Sci. Technol. 8, 1063–1075 (1994).
23. Makamba, H., Kim, J. H., Lim, K., Park, N. & Hahn, J. H. Surface modification of poly(dimethylsiloxane) microchannels. ELECTROPHORESIS 24, 3607–3619 (2003).
24. Xu, J. H., Li, S. W., Tan, J., Wang, Y. J. & Luo, G. S. Controllable Preparation of Monodisperse O/W and W/O Emulsions in the Same Microfluidic Device. Langmuir 22, 7943–7946 (2006).
25. Baret, J.-C. Surfactants in droplet-based microfluidics. Lab Chip 12, 422–433 (2012).
26. Dinh, H.-H.-Q., Santanach-Carreras, E., Schmitt, V. & Lequeux, F. Coalescence in concentrated emulsions: theoretical predictions and comparison with experimental bottle test behaviour. Soft Matter 16, 10301–10309 (2020).
27. Bezerra, M. D. A., Arruda, M. A. Z. & Ferreira, S. L. C. Cloud Point Extraction as a Procedure of Separation and Pre‐Concentration for Metal Determination Using Spectroanalytical Techniques: A Review. Appl. Spectrosc. Rev. 40, 269–299 (2005).
28. Perelomov, L. et al. Organoclays Based on Bentonite and Various Types of Surfactants as Heavy Metal Remediants. Sustainability 16, 4804 (2024).
29. Duran, M. et al. Microcapsule production by droplet microfluidics: A review from the material science approach. Mater. Des. 223, 111230 (2022).
30. Chachanidze, R., Xie, K., Lyu, J., Jaeger, M. & Leonetti, M. Breakups of Chitosan microcapsules in extensional flow. J. Colloid Interface Sci. 629, 445–454 (2023).
31. Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L. & Kaigala, G. V. Nip the bubble in the bud: a guide to avoid gas nucleation in microfluidics. Lab. Chip 19, 2296–2314 (2019).
32. Ghasemzaie, N., Jeyhani, M., Joshi, K., Lee, W. L. & Tsai, S. S. H. ATPSpin: A Single Microfluidic Platform that Produces Diversified ATPS-Alginate Microfibers. ACS Biomater. Sci. Eng. (2024) doi:10.1021/acsbiomaterials.4c00110.
33. Hakim Khalili, M. et al. Additive Manufacturing and Physicomechanical Characteristics of PEGDA Hydrogels: Recent Advances and Perspective for Tissue Engineering. Polymers 15, 2341 (2023).
34. Sun, X. et al. Facile fabrication of drug-loaded PEGDA microcapsules for drug evaluation using droplet-based microchip. Chin. Chem. Lett. 33, 2697–2700 (2022).
35. Polymers | Free Full-Text | Additive Manufacturing and Physicomechanical Characteristics of PEGDA Hydrogels: Recent Advances and Perspective for Tissue Engineering. https://www.mdpi.com/2073-4360/15/10/2341 (2024).