目录:
微流控芯片的微制造
在实验室芯片技术中,这些芯片由硅、玻璃或聚合物(如PDMS(聚二甲基硅氧烷))等材料制成。其生产方法根据所选材料而异。
以下内容大部分摘自Aryasomayajula等人撰写的《Springer纳米技术手册》(《微流控器件及其应用》)和Ren等人发表的论文《微流控芯片制造材料》[1]。
1. 硅或玻璃微流控芯片
- 第一代微流控材料,随着MEMS技术的引入而出现。
- 玻璃:透明、惰性,具有高热稳定性和化学耐受性。
- 硅:不透明但精确,可通过光刻实现亚微米级结构。
- 两者均可实现高分辨率通道,通道尺寸可达亚微米级且具有高重现性,适用于毛细管电泳(CE)、液滴形成及芯片内反应。
🛠️ 制造方法
- 硅材料:通过蚀刻和沉积技术实现的体刻蚀、表面刻蚀和埋置通道。
- 玻璃材料: 主要通过湿法/干法蚀刻和机械工艺制造。
⚠️ 限制
- 成本高,需要专业设备和有毒化学品。
- 不透气,易脆,且不适合细胞培养。
✅ 小结
硅和玻璃是高刚性材料,具有高精度和高温稳定性,但成本高且与生物或可扩展应用兼容性差——因此聚合物等替代材料应运而生。
2. 聚合物微流控芯片
- 聚合物在硅/玻璃之后出现,提供了低成本、灵活且易获取的替代方案。
- 可根据聚合物类型用于原型制作或批量生产。
🛠️ 聚合物类型及应用
🧼 弹性体(如PDMS)
- 柔性,适用于软光刻快速原型制作。
- 在学术研究中常用。
- 限制:疏水性、重现性差、耐压性低,难以批量生产。
🔍 热塑性塑料(如PMMA、COC、PC)
- 透明、生物兼容且成本低。
- 通过热模成型或注塑成型实现大规模生产的理想选择。
- 化学耐受性优于PDMS,但透气性有限,不太适合长时程细胞培养。
🔥 热固性塑料(如TPE)
- 在高温/溶剂环境下依然坚固稳定。
- 通过注塑成型制造,提供高精度。
- 由于成本较高,使用较少。
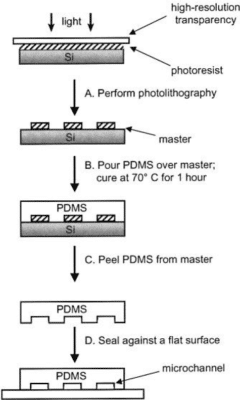
图1:(A)通过将含有微通道设计的高分辨率透明光罩曝光于光敏树脂上,制作出模具母版。(B)将液态PDMS倒在母版上,并在70°C固化1小时。(C)从母版上剥离PDMS复制件;(D)将复制件密封到平面上以封闭通道。整个过程约需24小时[2]。
✅ 小结
聚合物(尤其是用于原型制作的PDMS和用于工业化的热塑性塑料)现已成为微流控的首选材料,因其成本低、易加工且适用于多种应用。
3. 纸基微流控芯片
- 纸张多孔、由纤维素构成,可通过毛细作用自然吸液。
- 通道通过疏水图案化形成,将液体引导至亲水区域。
- 无需外部泵浦——液体被动流动。
🛠️ 制造方法
✅ 成本低且简单,非常适合便携式诊断工具。
常用技术:
- 蜡印刷(最普及)
- 喷墨印刷
- 柔版印刷
- 丝网印刷
- 光刻
- 纸张切割
在蜡印刷中,先生成图案,再加热熔化蜡以形成疏水屏障,从而引导液体流动。

⚠️ 限制
- 最小通道宽度约200 µm(而PDMS/玻璃可达约20 µm)。
- 对低表面张力液体的液体封闭性差。
- 与外部加压系统或泵不兼容。
- 至今已展示的高级微流控应用较少。
✅ 为什么使用纸基?
- 超低成本、一次性且易于制造。
- 非常适合现场快速检测和个性化诊断。
- 无需外部电源或设备。
4. 水凝胶微流控芯片
- 水凝胶是亲水、多孔、生物兼容的三维聚合物网络(天然或合成),可吸收超过90%的水分。
- 非常适合包埋细胞,创建类组织的生物环境和受控的三维微环境。
- 常见类型:琼脂糖、Matrigel、PEG-DA、海藻酸盐、壳聚糖。
为什么在微流控中使用水凝胶?
✅ 生物兼容——支持细胞存活和组织功能。
✅ 可渗透——促进营养物质、药物和信号分子的扩散。
✅ 透明——便于显微镜观察和成像。
✅ 模拟体内环境——有助于实现真实的三维细胞培养和化学梯度。
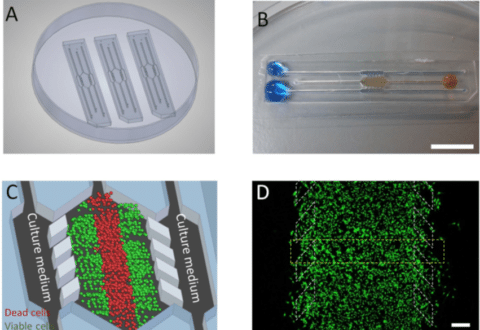
图2:(A)培养皿中放置了3个微设备,其中包含一个中央培养室(详见C)及6条通道。(B)一个微设备中填充(微黄色)胶原蛋白水凝胶,从右侧中通道流入中央培养室,同时两侧微通道灌注蓝色水液。(C)培养基通过侧通道灌注。(D)在微设备中使用荧光染料进行细胞监测[3]。
🛠️ 制造方法
在微流控系统中集成水凝胶的方法多种多样,包括基于柔性光刻的牺牲性或可重复使用模板法、光聚合、局部集成等[4]。
- 柔性光刻
- 使用模具(PDMS或光刻胶)。
- 倒入液态凝胶,固化后剥离。
- 可制作二维及层状准三维水凝胶微结构。
- 光聚合
- 利用紫外光实现高分辨率结构化。
- 三种方法:均匀曝光、基于光罩的印刷、直接写入。
- 实现精确的三维微结构。
- 局部集成/共层流
- 凝胶在微通道中并列流动,形成层状结构。
- 随后进行原位固化。
- 有助于构建动态多层结构。
- 牺牲模板
- 将可降解的三维模板涂覆凝胶后溶解,形成通道。
- 可构建复杂的类血管结构(如组织支架)。
⚠️ 挑战
- 在真正三维环境中精确控制几何形状十分复杂。
- 需要优化凝胶配方以兼顾固化性和生物兼容性。
- 某些凝胶可能机械强度低且批次差异较大(如Matrigel)。
芯片选型指南
- 确定您的用途:液滴混合、细胞测定、DNA分析等。
- 根据流动需求匹配通道设计:直通道、Y形、十字或H形网络。
1. 根据应用选择芯片材料
- 硅:化学稳定且导热性好,但不透明且易脆。
- 玻璃:透明、惰性、生物兼容,耐高压;适用于光学测定,但加工成本高。
- 聚合物(PDMS、PMMA、COC、PS、PC):
- PDMS:在研究中备受青睐——生物兼容、透气、柔韧、易于原型制作,但疏水且不适合高压环境。
- 热塑性塑料:自发荧光低、光学性能优异,可通过注塑成型实现规模生产。
2. 精准设计流路
- 根据流动需求选择通道类型(直通道、Y/十字/H形网络)。
- 根据芯片和管路几何形状进行阻力及剪切计算;使用工具可计算理想压力和流量范围。
3. 设置合适的压力/流量
- 在中等压力范围内工作(例如,对于2 bar系统,使用0.5–1.5 bar),以获得最佳分辨率。
- 调整管路长度和直径以微调阻力,同时避免堵塞。
4. 减少堵塞并控制剪切
- 狭窄通道会增加堵塞风险和阻力——建议选择适中尺寸。
- 通过压力调节控制剪切应力,尤其适用于脆弱细胞。
5. 确保系统兼容性
- 确认芯片、管路、泵/控制器、涂层和检测器之间的兼容性。
- 使用Fluigent或其他系统时,优先选择即插即用的集成方案。
摘要表
| 步骤 | 关键要点 |
|---|---|
| 定义应用 | 确定测定类型(如细胞、DNA、液滴、器官芯片) |
| 选择材料及制造 | 平衡光学清晰度、耐压能力和成本 |
| 设计微通道及管路 | 选择几何形状;根据目标流量/阻力确定尺寸 |
| 计算并优化流量/压力 | 使用计算工具;保持系统中等工况 |
| 检查集成就绪度 | 确保物理及功能兼容 |
有用工具及资源
- 计算器:压力与流量、剪切应力、液滴尺寸
- 材料指南:PDMS、玻璃、聚合物、硅的优缺点
- 涂层及表面处理:调整疏/亲水平衡,减少非特异性吸附
最终要点
要选择理想的微流控芯片,请从一开始就明确需求——应用→材料→设计→流体控制→系统兼容性。使用计算工具和既定指南,打造高效、精确、可靠且无不必要成本与复杂度的芯片。
- Ren, K., Zhou, J. & Wu, H. Materials for microfluidic chip fabrication. Acc. Chem. Res. 46, 2396–2406 (2013).
- McDonald, J. C. & Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491–499 (2002).
- Ayuso, J. M. et al. Development and characterization of a microfluidic model of the tumour microenvironment. Sci. Rep. 6, 1–16 (2016).
- Zhang, X., Li, L. & Luo, C. Gel integration for microfluidic applications. Lab Chip 16, 1757–1776 (2016).