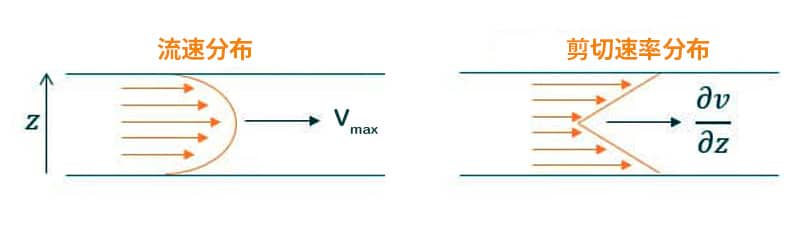剪切应力的物理定义
剪切应力是在表面上施加的切向力。流体剪切应力取决于流体的速度和粘度。因此,在牛顿流体的情况下,它可以简化为以下方程式:
τ = η * (∂v/∂z)
其中 η 是粘度(g/cm·s = 泊),∂v/∂z 是速度梯度或剪切速率(s⁻¹)。
在层流微流控通道中,速度分布呈抛物线形。通道中心速度最大,通道壁速度最小,因此通道壁处的剪切应力最高,而通道中心的剪切应力最低。(图 1)
使用我们的剪切应力计算器来确定您的实验参数:设置系统中要施加的流速或压力、微流控芯片的尺寸和管路长度,以在流动条件下为您的细胞培养施加正确可控的剪切应力。
剪切应力对细胞的影响
在常见的体外实验中,细胞在培养皿中培养且不引入介质流动,这是一种不完整的模型,无法全面体现细胞行为。在生物体内,细胞持续暴露于流体运动产生的剪切应力中,在体外系统中引入剪切应力至关重要,原因包括:
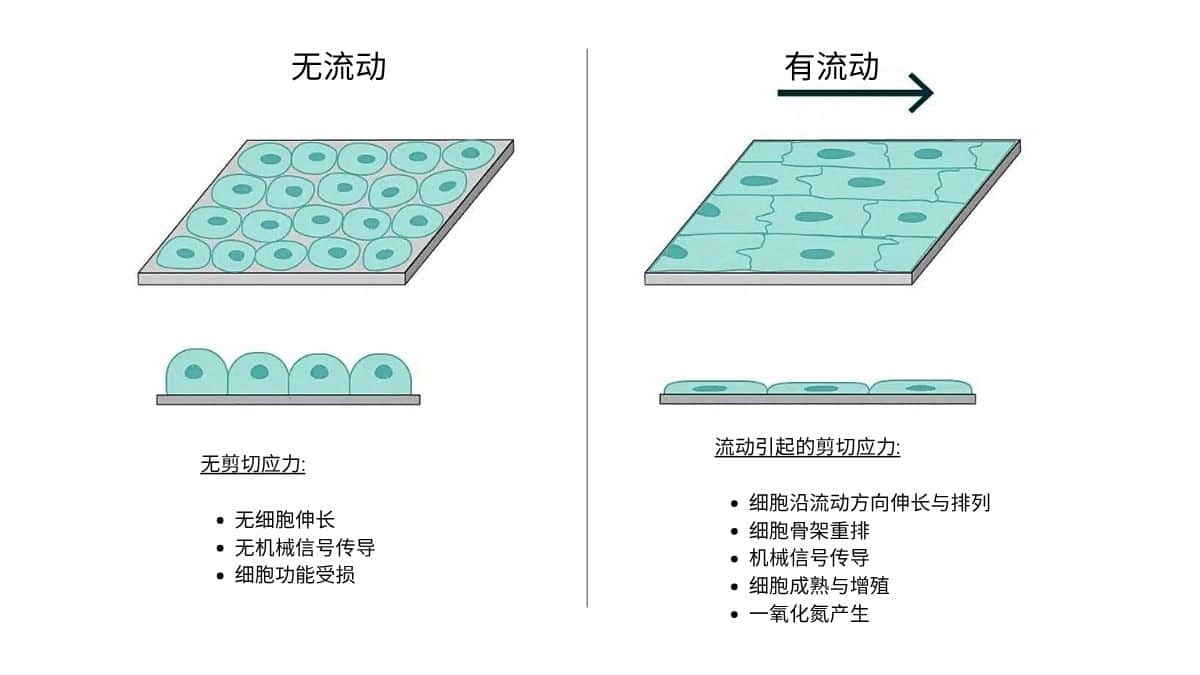
- 机械刺激: 流体流动产生机械刺激,促进细胞沿流动方向伸长——尤其是在内皮细胞和其他贴壁细胞培养中(图 2)[1]
- 内皮细胞反应: 内皮细胞对剪切应力尤为敏感,会发生细胞骨架重构[2],这一反应有助于维持血管稳态,并影响血管生成和血管重塑等过程[3]
- 癌细胞动力学: 在癌症研究中,剪切应力被认为促进转移级联过程,如细胞外渗和间质迁移。研究发现在管腔流动下,肿瘤细胞的平均血内运动速度约为12.5 μm/h,而在静态条件下约为9.4 μm/h[4]。
- 提高生理相关性和精确性: 与轨道流动相比,在层流条件下培养的人脐静脉内皮细胞(HUVECs)表现出更具生理相关性的组织因子表达[5]。
- 组织特异性剪切应力: 不同组织体验到不同的生理剪切应力水平,在设计和模拟体外实验时需要加以考虑。
| 细胞类型 | 剪切力值 (Pa) | 剪切力值 (dyn/cm2) |
|---|---|---|
| 动脉 [6] | 1-2 | 10-20 |
| 静脉[6] | 0.1 -0.6 | 1-6 |
| 小鼠胚胎肾 [7] | 0.04 – 0.5 | 0.4 – 5 |
| 人肾脏[8] | 0.03 -0.12 | 0.3 -1.2 |
| 肺泡上皮细胞[9] | 0.4 -1.5 | 4 -15 |
*更多数值请下载完整专家Review
如何在细胞微生理系统中控制剪切应力
随着微流控技术的发展,实现了对流速和微通道几何形状的精确控制,研究人员能够微调施加于细胞的剪切应力。早期研究表明,特定水平的剪切应力可影响内皮细胞的结构和功能[10]。
在过去20年中,微流控技术的进步加深了我们对这些效应的理解。近年来,功能组织在微流控芯片中培养的器官芯片模型的发展表明,受控的机械刺激对于调节细胞行为以及对病原体和药物的响应至关重要[11]。
控制剪切应力的关键变量包括:
- 精确的流速控制: 在长时间内保持稳定且可重复的流速,以确保一致的剪切应力暴露。
- 微通道几何形状: 微通道的形状、宽度和高度直接影响细胞所受剪切应力的分布。
- 流体粘度: 培养基的粘度影响剪切应力。BSA含量、化学添加剂和温度的变化都会影响培养基粘度。
- 脉动流与稳定流: 模拟生理条件需要动态流型(如脉动流或振荡流)。
- 细胞接种密度和粘附性: 细胞的融合度和附着情况影响其对剪切应力的响应;优化接种条件可确保均匀暴露。
- 基底刚度和弹性: 微流控芯片基底的机械性能影响细胞感知剪切力的方式。
为什么选择与 Fluigent 合作?
我们致力于通过简化复杂性的工具推动器官芯片研究。Fluigent 的压力驱动泵结合流量监测和控制,可在微流控环境中实现对作用于细胞或组织的剪切应力的精确控制。
无论您是在进行定制芯片的原型设计还是使用商业系统,让我们帮助您实现可重复且具生理相关性的实验结果。
Related ressources
参考文献
[1] Helmke B.P, Rosen A.B & Davies P.F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys J (2003). doi: 10.1016/S0006-3495(03)75074-7
[2] Malek A.M & Izumo S. Mechanism of endothelial cell shape change and cytoskeletal remodeling in response to fluid shear stress. J Cell Sci (1996). doi: 10.1242/jcs.109.4.713
[3] Campinho P, Vilfan A, Vermot J. Blood flow forces in shaping the vascular system: a focus on endothelial cell behavior. Front Physiol (2020) doi: 10.3389/fphys.2020.00552
[4] Hajal, C., et al. The effects of luminal and trans-endothelial fluid flows on the extravasation and tissue invasion of tumor cells in a 3D in vitro microvascular platform. Biomaterials (2021). doi: 10.1016/j. biomaterials.2020.120470
[5] Rochier A., et al. Laminar shear, but not orbital shear, has a synergistic effect with thrombin stimulation on tissue factor expression in human umbilical vein endothelial cells. J Vasc Surg (2011). doi: 10.1016/j.jvs.2011.01.002
[6] Lipowsky H.H., et al. The distribution of blood rheological parameters in the microvasculature of cat mesentery. Circ Res. (1978). doi: 10.1161/01.res.43.5.738
[7] Kimura H., et al. Effect of fluid shear stress on in vitro cultured ureteric bud cells. Biomicrofluidics (2018). doi: 10.1063/1.5035328.
[8] Ross E.J., et al. Three dimensional modeling of biologically relevant fluid shear stress in human renal tubule cells mimics in vivo transcriptional profiles. Sci Rep (2021). doi: 10.1038/s41598-021-93570-5
[9] Flitney E.W., et al. Insights into the mechanical properties of epithelial cells: the effects of shear stress on the assembly and remodeling of keratin intermediate filaments. FASEB J (2009). doi: 10.1096/ fj.08-124453
[10] Dewey C.F Jr. et al. The dynamic response of vascular endothelial cells to fluid shear stress. J Biomech Eng (1981). doi: 10.1115/1.3138276.
[11] Thompson et al. Mechanical Stimulation: A Crucial Element of Organ-on-Chip Models. Frontiers in Bioengineering and Biotechnology (2020). doi: 10.3389/fbioe.2020.602646