器官芯片应用中的微流控流体控制器
器官芯片可在微尺度装置中模拟人体器官的结构与功能[1]。这类装置通常由置于微流控通道中的细胞或类器官构成,旨在逼真再现特定器官的生理反应。
通过重建器官的微环境与细胞相互作用,OOC 技术相较传统的二维细胞培养或动物模型,更能提供贴近生理的研究平台,用于探究器官功能、疾病机制及药物反应。
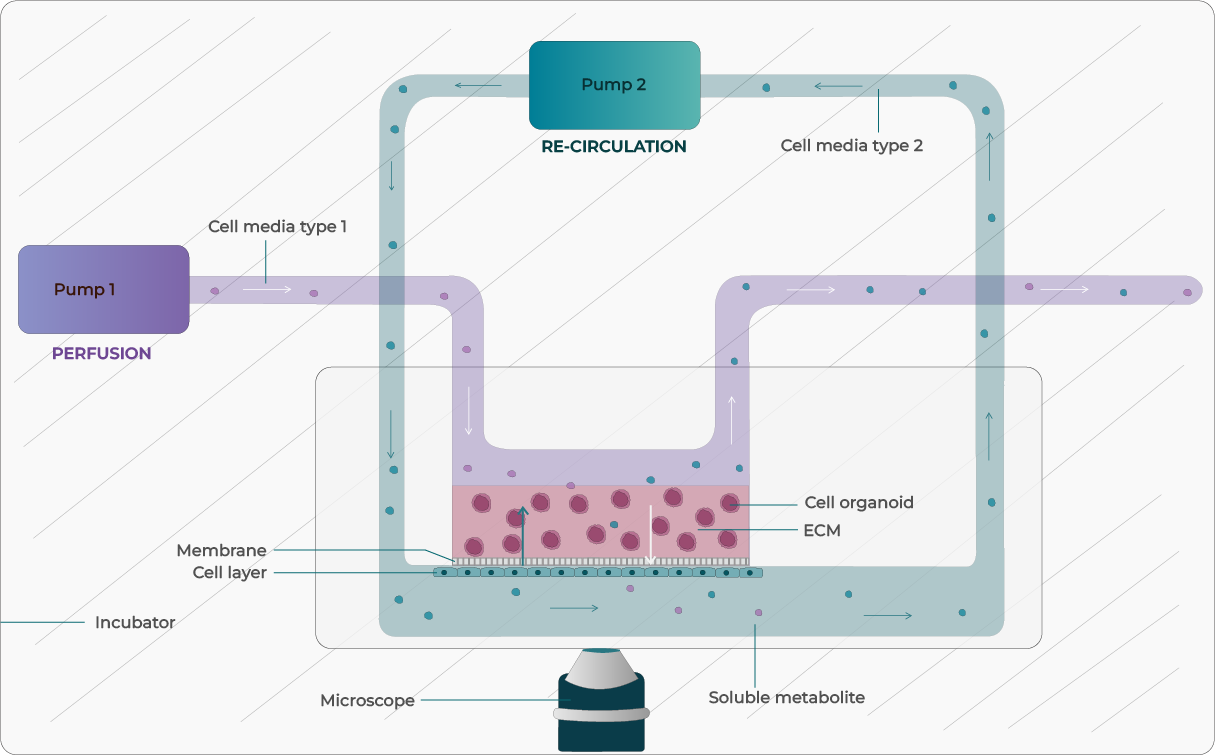
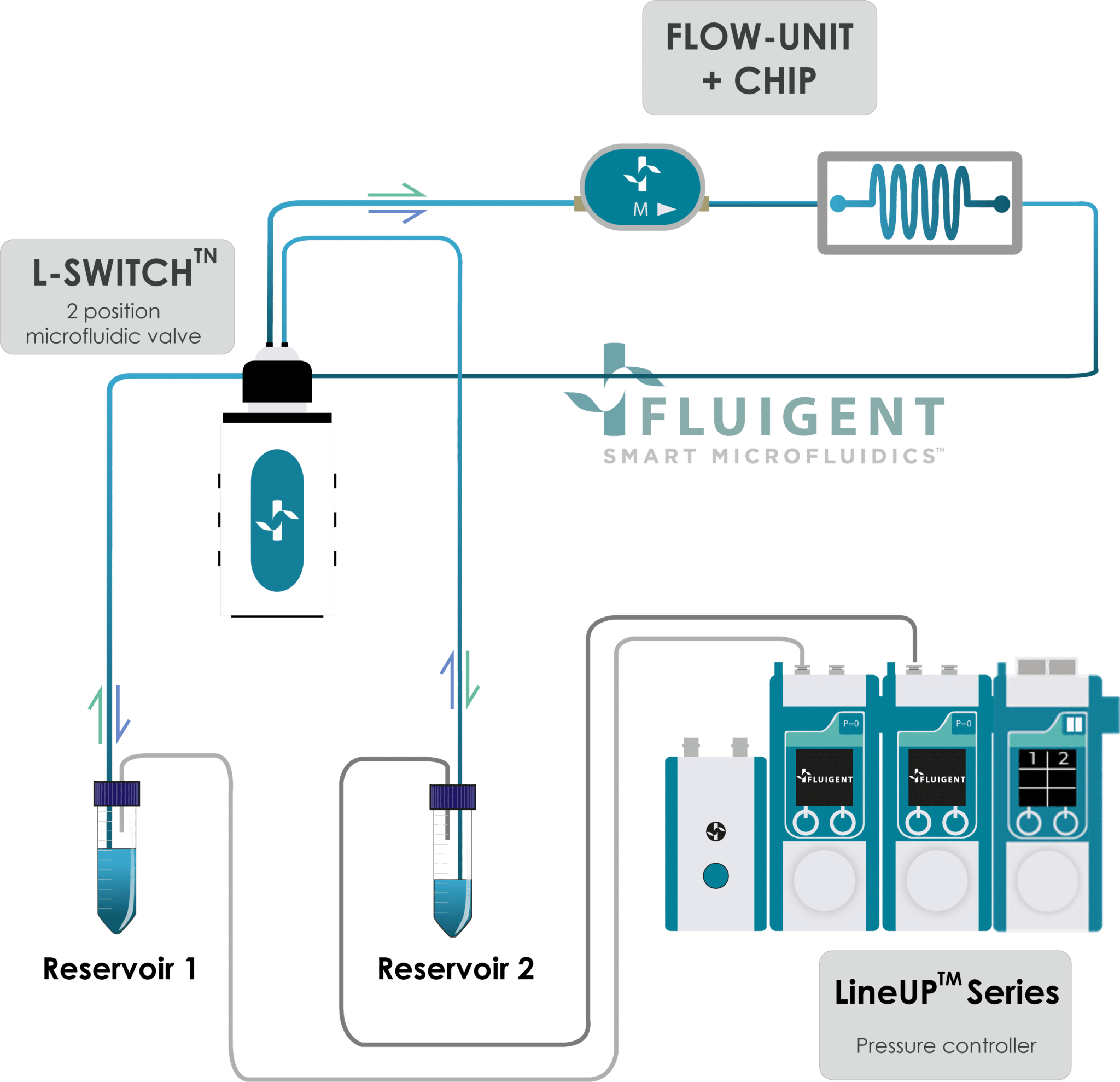
图 1:整合培养基灌流与循环的器官芯片示意图
在 OOC 装置中复现生理微环境的关键之一,是构建可控的液体灌流系统,以输送营养、药物、代谢物与转录因子等。研究者可选择多种流体控制技术,各有优劣(见表 1)。
1. 蠕动泵
蠕动泵通过挤压柔性管实现正排量,形成脉动流。其设备普及、上手容易,兼容多种流体,并因液体仅接触管路而具备较低污染风险。但其流速与压力控制能力较弱,且脉动特性不一定适合血管化等对稳态剪切要求高的模型。
2. 注射泵
注射泵由电机驱动,通过一个或多个注射器进行输注。其界面直观、易于编程,可设定并调整流速、体积与输注速率等参数。
根据编程设置,注射泵既可提供连续流,也可提供间歇流,适用于需要特定流型的实验。
尽管如此,注射泵也存在局限:
- 有效低流速控制与响应性不足
- 注射器容积有限,需定期补液
- 液体直接接触注射器,污染风险增加
难以实现培养基的连续回收循环。
3. 压力式流体控制器(压力泵)
压力式流体控制器利用气动系统产生压差,驱动液体在微流控芯片中流动。其优势包括:高流速稳定性与快速响应;既可实现连续流,也可编程实现脉动流;还能便捷地集成多器官系统。具体选择何种灌流技术,应依据 OOC 对流速、压力/流型、脉动需求与细胞相容性的要求而定。
表 1:OOC 常用微流控技术对比
| 蠕动泵 | 注射泵 | 压力泵 | |
|---|---|---|---|
| 流量稳定性与精度 | 低 | 中 | 高 |
| 时间响应性 | 高 | 低 | 高 |
| 流体再循环 | ☑️ | ✖️ | ☑️ 配 L-switch |
| 微小体积注入能力 | 低 | 高 | 中 |
| 样品搅拌/扰动 | ☑️ | ✖️ | ☑️ |
| 复杂流型(可编程) | ✖️ | ✖️ | ☑️ LineUp 系列) |
为什么在器官芯片上采用压力控制?
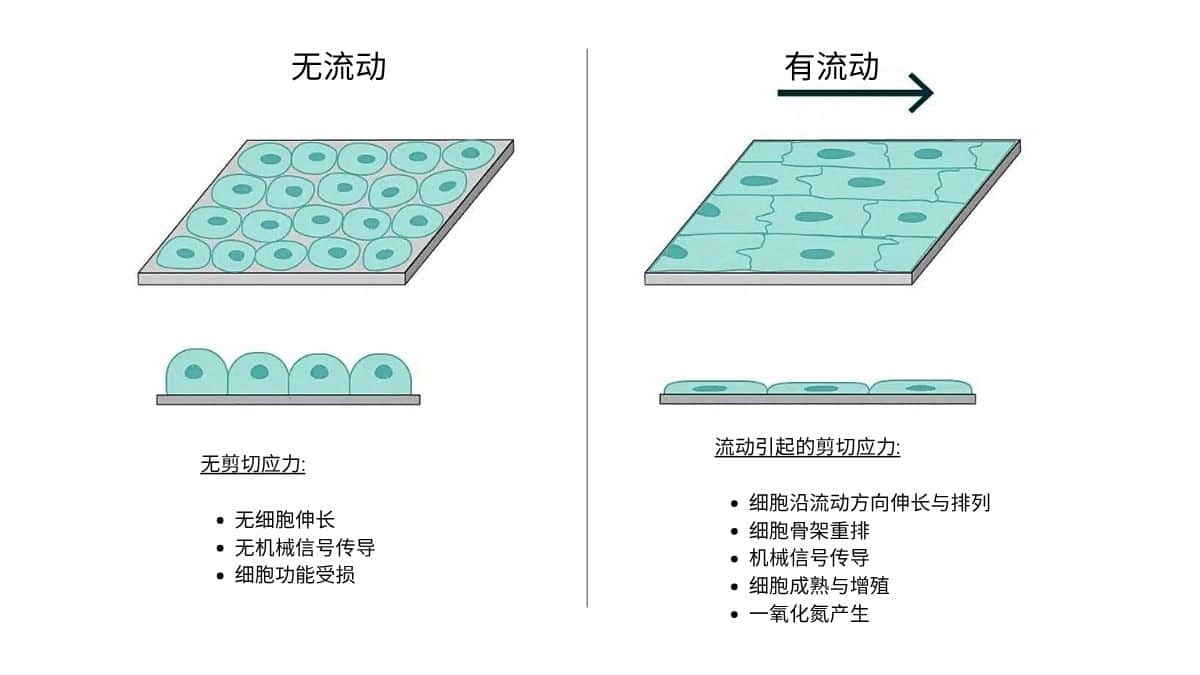
压力控制微流控可精确再现实验中细胞/组织所经历的流速、剪切应力与机械力,贴近体内生理条件,从而提升实验结果的可靠性与可重复性。
由于压力本身是流动的内在驱动力,调节压力即可细腻地操控流体动力学过程,建立生理梯度,并向细胞提供特定的机械信号,影响其行为、分化与功能。这一能力支撑了复杂微环境的构建——从精确的血管剪切分布到明确的间质压力场。
精确的压力控制也是 OOC 内部药物递送与灌流的基础,使细胞/组织能够受到可控的药物、毒素或其他物质暴露,从而评估其对器官功能与反应的影响。
器官芯片应用中的关键考量
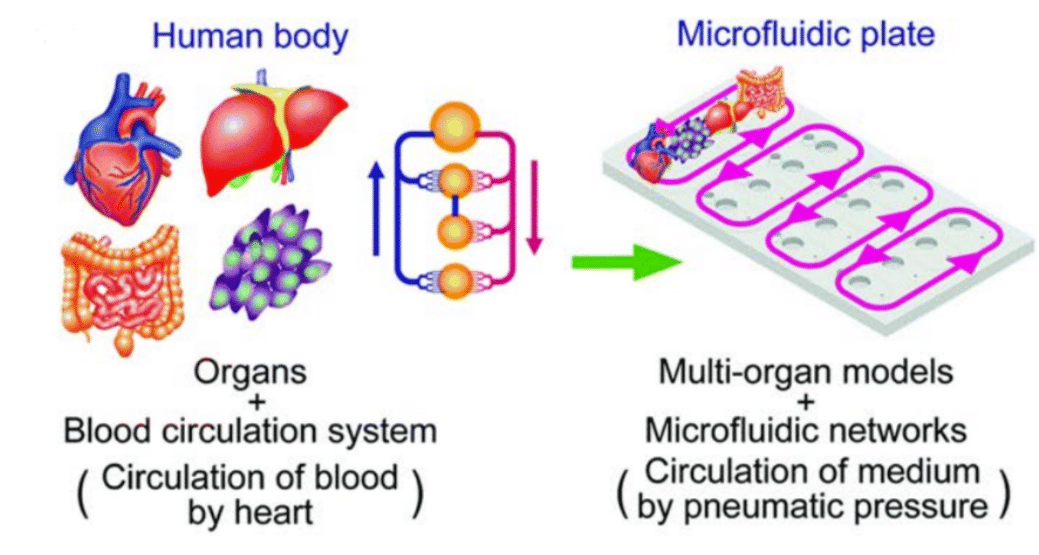
OOC 中的培养基灌流相当于“循环系统”,维持营养与代谢废物的浓度梯度以实现对流传输[2]。选择与器官芯片连接的微流控灌流系统时,应综合考虑:
- 流速、压力控制与脉动性
复现实体内微环境需针对不同器官匹配相应条件。肺芯片用于模拟呼吸运动与气流,通常需要较低至中等的流速(每分钟数微升)与温和压力,以准确再现呼吸动力学和肺泡环境[3]。心肌芯片则多需脉动流以模拟心肌收缩,常对应更高流速(每分钟数十至数百微升)与中高压力能力,才能形成贴近生理泵动的流型。
- 细胞活性与剪切应力
OOC 培养活细胞/组织,敏感于机械力与流体条件。过高剪切会影响细胞活性、增殖与功能。因此需评估泵型所致剪切水平,在确保足够流量的同时,尽量降低对细胞的不良影响。以神经细胞为例,其对剪切应力尤其敏感,需严格控制流速,避免破坏细胞网络或诱发损伤[4]。
- 系统集成与兼容性
OOC 常用于研究多器官交互(如肝-肺串联以研究药物代谢与毒性)。各器官模型所用系统需优化,以实现芯片间的通量与信息交换。有些模型还集成 pH、氧气与电活动传感,因此需确保与压力控制器的兼容性。由于长期培养与成像/分析至关重要,还需考虑与生物安全柜、成像/分析设备的配套,包括摆放、取样便利与光学透过性。
- 污染风险
体外模型必须保持无菌以降低变异、保证重复性。某些泵的液体会接触内部部件,增加污染风险。器官芯片应用更适合选择尽量避免流体接触内部机械部件的泵型。
走近微流控压力控制
OOC 的压力控制系统
在微流控系统中,下列组件协同工作,使研究者能够模拟动态微环境、维持长期实验的稳定条件,并精准控制流向。
| 组件 | 功能 | 在 OOC 系统中的作用 |
|---|---|---|
| 压力源 | 产生并调节流体驱动力 | 驱动组织/器官模型灌流 |
| 压力与流量传感器 | 监测通道内压力与流速 | 保障生理范围内的压力/流量,避免损伤敏感细胞 |
| 压力控制器 | 基于传感反馈调节流动以维持设定 | 实现稳定的长期培养,并对芯片环境变化(如细胞过度增殖导致的堵塞)做出动态响应 |
| 阀 | 导流/开闭/限流 | 实现多路复用、培养基再循环、定时刺激与多器官互作研究 |
| 反馈控制系统(如软件控制) | 利用实时数据动态调整压力或流量 | 支持脉动流、自动化流程与稳定重现生理动力学 |
通过整合上述组件,研究者可利用 Fluigent 的微流控压力控制方案(见图 2)在器官芯片中实现培养基的闭路循环,从而构建精准的流体环境。
该方案与 Beonchip 合作验证,并与传统蠕动泵对比,评估流速稳定性对细胞行为的影响。由于内皮细胞对微小流速变化极其敏感,在器官芯片研究中维持恒定剪切应力对保持生理相关性至关重要。
Omi:一体化器官芯片流体平台
Omi 平台在 Fluigent 成熟的压力式微流控体系之上,提供包含压力源、传感器与阀的模块化一体化方案,用于管理 OOC 应用中的复杂流体流程。
Omi 扩展了经典 Fluigent 组态的能力,提供统一界面以实现精确压力调控、流量控制与自动换路,从而稳定复现实验流程,如灌流、再循环、注入与取样等。
核心技术特性包括:
- 通过通用适配器实现芯片兼容,可集成多种 OOC 装置
- 支持 Wi-Fi 远程操作与平板应用(Android)
- 云端数据存储,便于监控与实验追踪
- 可编程流体流程,适用于药物、毒素与代谢物等化合物测试

基于 Fluigent 系统的器官芯片应用
近年来,多种 OOC 模型快速发展——如肾脏芯片[2][8]、肺芯片[3]、心脏芯片[5]、皮肤芯片[6]、胰腺芯片[7]与脑芯片[8]等。压力控制微流控在其中发挥关键作用,主要体现在:
- 提供可控、定向的流体暴露,更贴近体内灌流
- 构建梯度流场,支持精准给药研究
- 支持多类型细胞共培养与空间层次,重建复杂器官结构
- 利用人源细胞,获得较动物模型更具生理相关性的体系
微流控 OOC 平台正推动个性化医疗与高通量药筛、单细胞分析、细胞互作研究与疾病建模等领域的革新,从而深化对人体生理的理解并助力更有效疗法的开发。
全球研究团队已广泛采用 Fluigent 的微流控压力控制系统来构建与研究器官芯片模型
Omi 用户反馈

“在攻读博士期间,我多次在细胞生物学实验中使用 Omi。就芯片上器官的再循环与灌流而言,Omi 是我用过最简洁易用的工具。所有功能集成在一台设备里,配套无菌耗材也非常易上手,极大降低了污染风险。[Saut de retour à la ligne]平板与网页版应用可实时监控实验进程,是一款真正友好、高效的工具。期待用 Omi 开发更多生物学应用!”
Arthur Salles,法国国家科学研究中心(CNRS)LIED 实验室,巴黎大学博士生
血管芯片
为解决多路血管芯片(VoC)模型中稳定流场难以复现的问题,Valeria Orlova 团队[10]开发了“流体电路板(FCB)”,可用统一控制参数同时灌流多达 12 个三维 VoC。
该系统整合 Fluigent 的 Flow EZ 压力控制器、Link-Up 模块与流量传感器,确保壁面剪切与血流力学条件一致性——这对维持内皮功能与血管完整性至关重要。
这种多路并行思路有助于三维血管模型的规模化与标准化。

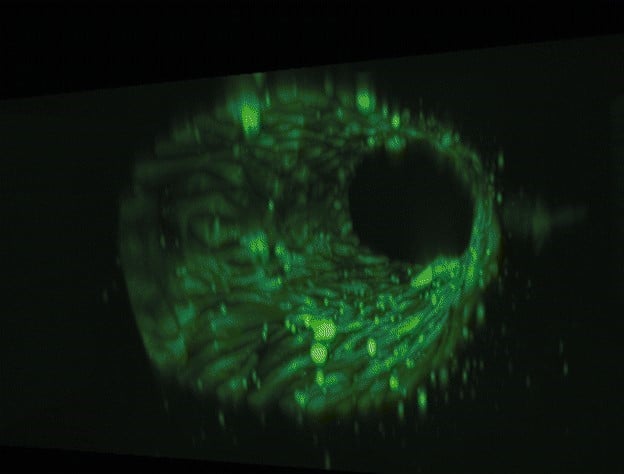
图 4: 流体电路板与外部储液瓶在加热模块中的实物图,以及血管芯片的三维重建图。
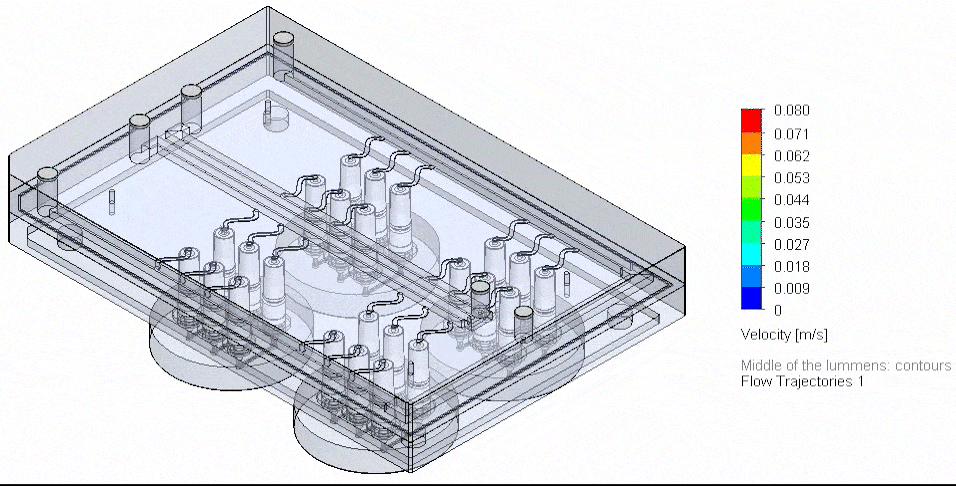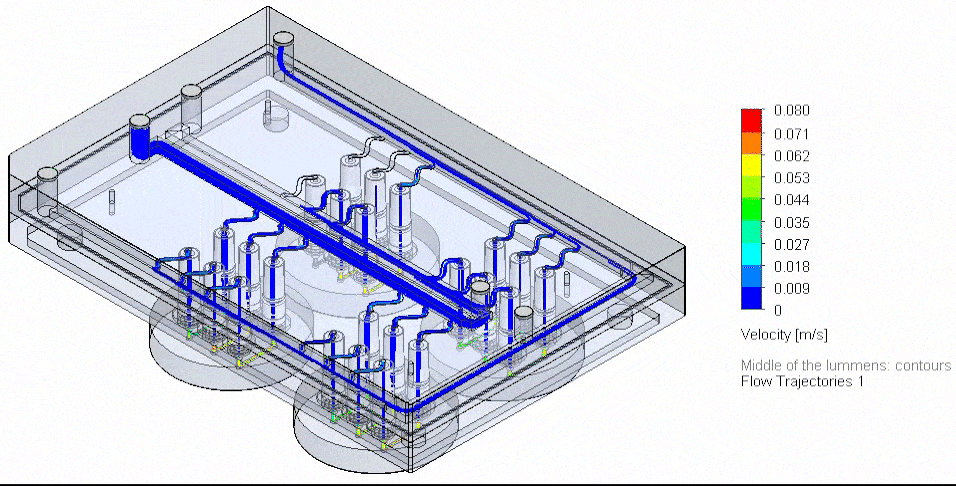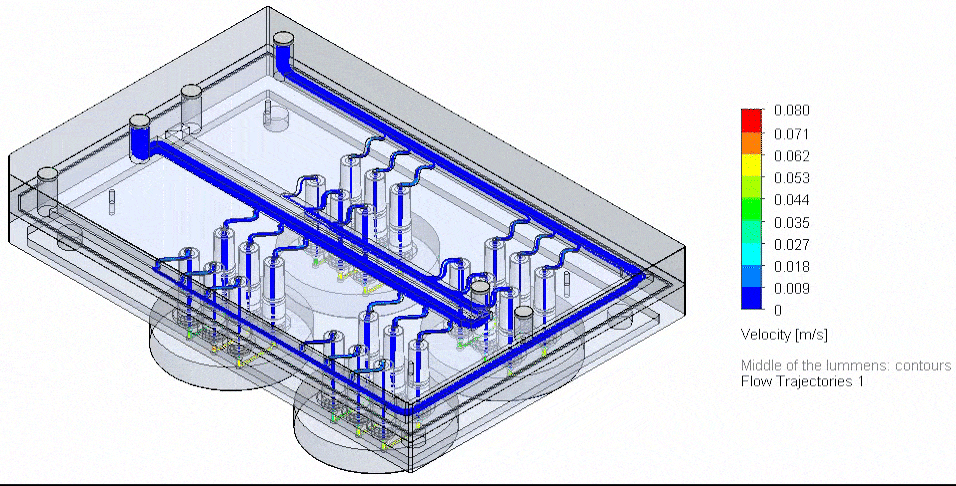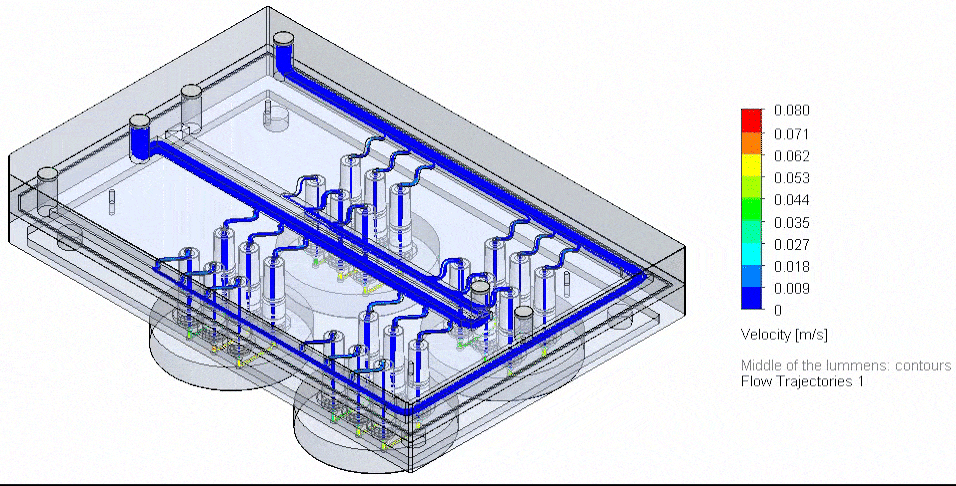
肿瘤芯片
Van Gent 团队开发了肿瘤芯片微流控平台(图 6),在受控条件下利用肿瘤组织切片评估患者对治疗的反应[11]。其压力控制系统采用 Fluigent 的 MFCS-EZ 高通量平台,可在多达 14 天内维持乳腺癌与前列腺癌 PDX 切片的细胞活性与增殖,并研究了其对顺铂化疗的反应。该平台未来可用于与临床治疗相匹配的患者肿瘤活检研究。
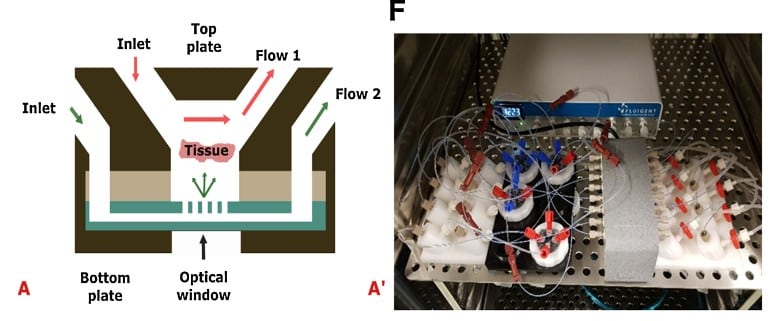
图 6:(A)肿瘤芯片系统的剖面示意,显示向组织切片的扩散与灌流。(A’)平台连接 Fluigent 微流控流体控制系统与流量传感器(FLOW UNIT-S),并在培养全程由 Fluigent 软件控制。
软骨芯片
Séverine le Gac 团队利用微流控控制系统(MFCS-EZ、2 个开关与一块切换板)构建软骨芯片模型,模拟软骨细胞对外界(机械/化学)刺激的响应,并解析骨关节炎等疾病的诱因[12](图 7)。该装置可对三维细胞培养实施机械刺激并原位监测响应,同时提供动态培养条件。
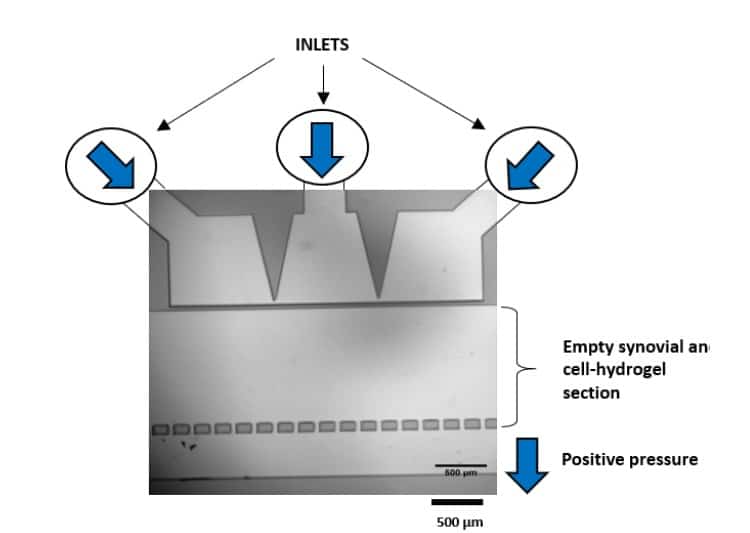
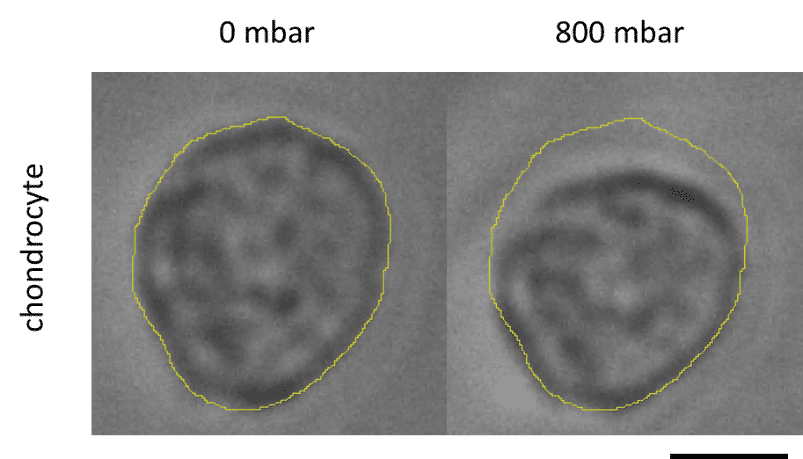
图 7: 机械刺激后软骨细胞的形变。
肠道芯片模型
里尔巴斯德研究所的研究人员开发了性价比高、易用的肠道芯片平台——3DP-µGut,旨在扩大 OOC 技术在肠道健康与宿主-病原互作研究中的普及。
与依赖昂贵商用芯片、高阶 CAD 与洁净室的传统 GoC 不同,3DP-µGut 可用常规 SLA 3D 打印机和开源设计文件制造,低成本实现中等通量、成像友好的可重复芯片。
该模型以 Caco-2 细胞验证:7 天后形成三维上皮,逼真模拟原生肠道结构。其开放式设计兼容多种微流控系统,包括验证中使用的 Fluigent Omi 一体化平台与 Flow EZ 压力控制器。
如需了解 GoC 的实施、流体控制策略与宿主-微生物互作建模:
网络研讨会:流动在器官芯片中的重要性——以肠道芯片为例
里尔巴斯德研究所专家将展示基于 Omi 自动化平台支持的肠道芯片模型,重点介绍其应用与优势。
结论
压力控制微流控以精确、稳定且高响应的流体管理能力,成为推动 OOC 研究的关键技术。与其他方式相比,基于压力的系统更能还原生理状态,支持长期细胞活性、提升实验可重复性,并实现复杂流型。无论是模拟血管剪切,还是实现多器官互作,压力控制都能确保 OOC 平台的性能与可靠性。借助 Fluigent 等一体化方案,研究者可为 OOC 实验快速搭建可定制系统。
如需更多信息或技术交流
相关产品
相关技术文档
References
- Leung CM, de Haan P, Ronaldson-Bouchard K, et al. A guide to the organ-on-a-chip. Nat Rev Methods Primers. 2022;2:33. doi:10.1038/s43586-022-00118-6
- Lee SKJ. Kidney-on-a-Chip: a new technology for predicting drug efficacy, interactions, and drug-induced nephrotoxicity. Curr Drug Metab. 2018;19(7):577–583.
- Zamprogno P, Wüthrich S, Achenbach S. Second-generation lung-on-a-chip with an array of stretchable alveoli made with a biological membrane. Commun Biol. 2021;4:168.
- Regmi S, Fu A, Luo K. High shear stresses under exercise condition destroy circulating tumor cells in a microfluidic system. Sci Rep. 2017;7:39975. doi:10.1038/srep39975.
- Liu H, Bolonduro OA, Ning Hu JJ, Rao AA, Duffy BM, Huang Z, et al. Heart-on-a-Chip model with integrated extra- and intracellular bioelectronics for monitoring cardiac electrophysiology under acute hypoxia. Nano Lett. 2020;20(6):2585–2593.
- Lukács B, Bajza Á, Kocsis D, Csorba A, Antal I, Ivan K, et al. Skin-on-a-Chip device for ex vivo monitoring of transdermal delivery of drugs—design, fabrication, and testing. Pharmaceutics. 2019;11(9):445.
- Mun KS, Arora K, Huang Y. Patient-derived pancreas-on-a-chip to model cystic fibrosis-related disorders. Nat Commun. 2019;10:3124.
- Raimondi LI, Tunesi M, Comar M, Albani D, Giordano C, et al. Organ-On-A-Chip in vitro models of the brain and the blood–brain barrier and their value to study the microbiota–gut–brain axis in neurodegeneration. Front Bioeng Biotechnol. 2020;8:435.
- Menéndez AC, Du Z, van den Bosch TPP, Othman A, Gaio N, Silvestri C, et al. Creating a kidney organoid vasculature interaction model using a novel organ-on-chip system. Sci Rep. 2022;12(1):20699
- de Graaf MNS, Vivas A, Kasi DG, van den Hil FE, van den Berg A, van der Meer AD, Mummery CL, Orlova VV. Multiplexed fluidic circuit board for controlled perfusion of 3D blood vessels-on-a-chip. Lab Chip. 2023; 23:68-181.
- Chakrabarty S, Quiros-Solano WF, Kuijten MMP, Haspels B, Mallya S, Lo CSY, et al. A microfluidic cancer-on-chip platform predicts drug response using organotypic tumor slice culture. Cancer Res. 2022;82(3):510-520
- Paggi CA, Hendriks J, Karperien M, Le Gac S. Emulating the chondrocyte microenvironment using multi-directional mechanical stimulation in a cartilage-on-chip. Lap Chip. 2022;22(9):1815-1828