什么是微流控灌流
定义“微流控灌流”,并将其与一般的连续流区分:
灌流”通常指将液体通过某一结构(如组织或通道)受控地输送,该术语主要源自医学领域。在微流控中,灌流是指液体在微米级通道内的连续流动,常用于指代组织或反应区的流体输运。[1][2]
随着该领域不断发展,微流控灌流在活细胞分析、器官芯片平台以及单分子检测等高灵敏度分析中发挥着关键作用。无论采用连续、并行还是连续灌流,都必须精确控制流体动力学参数——如流速、层流/湍流状态以及流向。
表1 微流控灌流在生命科学研究中的相关性
| 应用领域 | 用途 |
|---|---|
| 器官芯片 / 动态细胞培养 | 持续灌流培养基以复现生理相关的流动条件,包括剪切力、营养和氧气交换以及代谢废物清除,从而模拟体内微环境。 |
| 活细胞成像 长时程显微观察 | 在成像过程中持续供给营养和试剂,以维持细胞活性并实现对细胞过程的实时观察。 |
| 药物响应测试 | 以动态方式给药与取样,评估细胞对剂量的依赖性响应,支持高通量筛选与毒理评价。 |
| 灌流生物反应器与细胞分选 | 放大体系采用连续灌流来制备生物试剂(细胞、DNA、外泌体)并进行分选与质量控制。 |
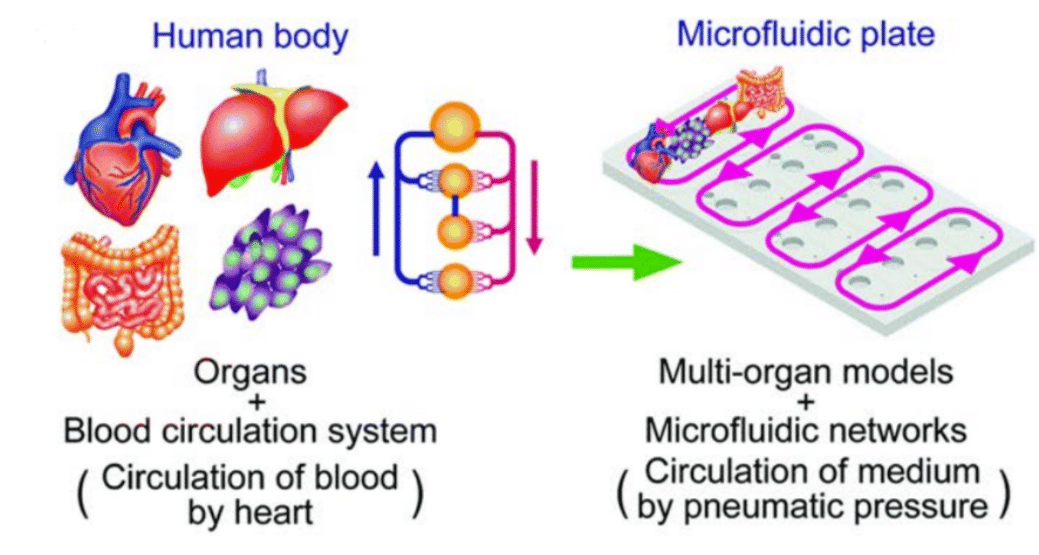
与静态培养相比,在器官芯片中,灌流可营造更接近体内的微环境。通过减少人工干预和环境波动,灌流可提供无菌而稳定的条件,从而支持长周期实验,如活细胞成像、钙转运监测和药物测试。灌流体系能在较长时间内提升细胞活性,并实现对多种化合物的精准、定量暴露。
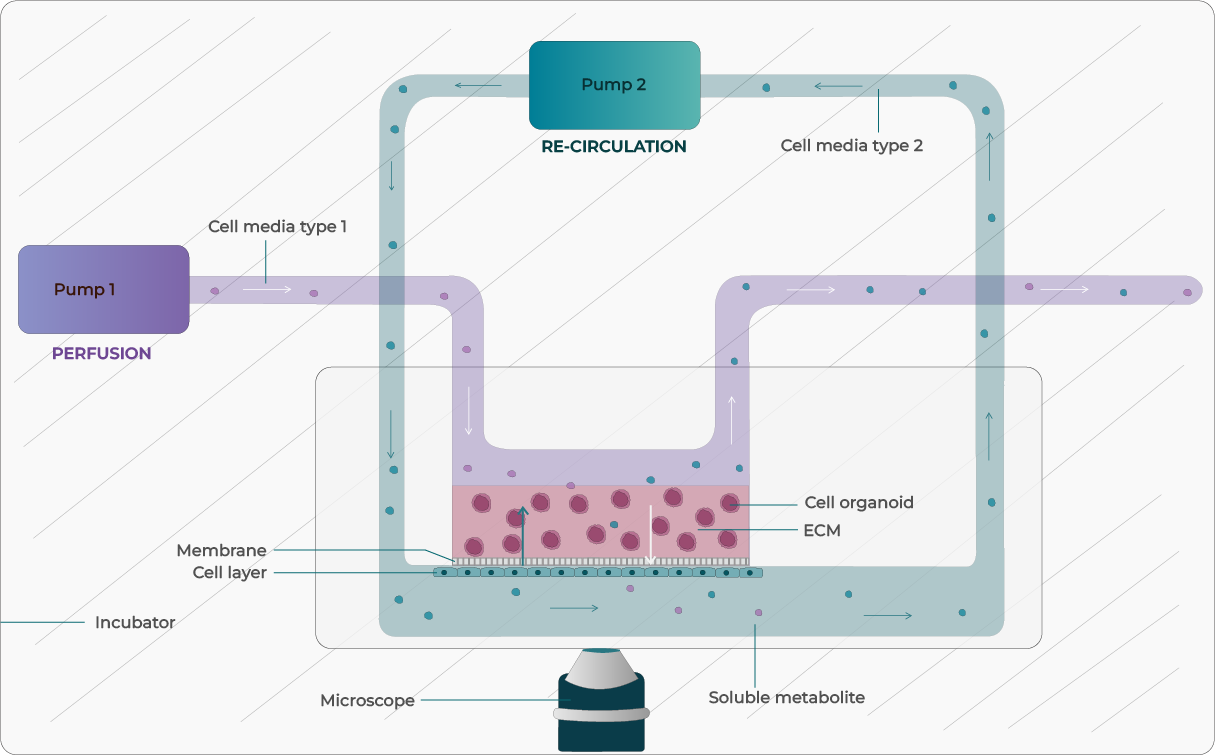
图1 器官芯片系统中的微流控灌流示意(开环与闭环,即循环)
微流控灌流的最佳实践
高效灌流依赖于合适的(微流控芯片)材料、精确的通道结构以及与目标生物/化学应用相匹配的设计策略的综合集成。
基于应用需求选择材料
根据具体应用,微流控芯片材料需要综合考虑力学性能、化学相容性和气体渗透性等因素,并针对性地优化。这些选择应以研究目标和所需生物模型为导向。
常见微流控芯片材料:
- PDMS(聚二甲基硅氧烷):因其良好的气体渗透性常用于供氧,但会吸附小分子疏水物质,可能影响药物毒理学实验的准确性[3]。
- 玻璃与热塑性材料(如PMMA、COC):通常化学惰性、低吸附,适用于要求极低浸出和吸附的应用。
- 水凝胶:作为全柔性微流控系统的生物相容支架材料逐渐兴起,尤其适合组织仿生和三维培养环境
人体各组织在功能与形态上差异显著,因此仿生模型需据此选择材料。例如,模拟骨组织(杨氏模量约20 GPa)与模拟脑组织(约2 kPa)所需材料差别很大[5][6]。低氧环境更适合采用玻璃或低渗透性的热塑材料;软组织建模更适合柔性膜或水凝胶。
除材料本身外,还可通过表面改性来提升生物功能适配性:
- 提升细胞黏附:涂覆ECM蛋白(如纤连蛋白、胶原)。
- 抑制非特异吸附:PEG化、BSA涂层或其他防污涂层[7]。
- 等离子体氧化或化学官能化可提高表面亲水性与润湿性。
优化芯设计与尺寸
通道设计会影响微流控体系中的流体动力学与细胞响应。微环境结构决定细胞所感知的力学信号[8];通道尺寸与体积会影响试剂的扩散及随后的生物学相互作用。
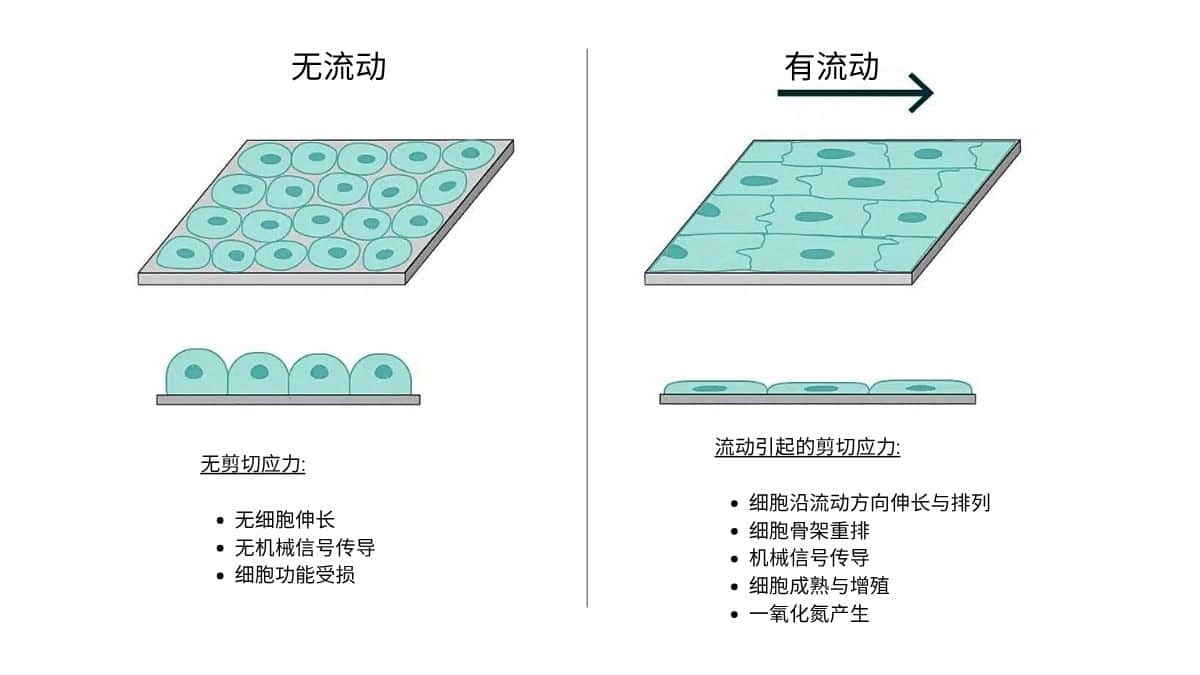
- 剪切力会影响细胞形态、迁移与基因表达等关键过程。设定流动条件时需结合通道几何与流速,使剪切力 接近体内水平(通常1–20 dyn/cm²,视细胞类型而定)。
- 灌流通道尺寸影响试剂扩散与暴露时间。尽管扩散参与分子运输,但在灌流实验中主导细胞响应的通常是试剂对流[9]。精确控制通道尺寸与流速,可确保细胞获得明确的浓度与时间梯度。通道尺寸的波动会改变流速与停留时间,导致供给不一致或扩散占主导,从而削弱浓度梯度并降低实验重现性。以灌流优化为目标进行通道设计,有助于获得可重复的细胞响应,这对定量生物学实验至关重要。
- 良好密封对维持受控流体环境至关重要。未封闭接口、层间粘接不良或膜未覆盖等都会引发泄漏,造成非期望流路、交叉污染或试剂损失,扰乱流体动力学。因此需建立泄漏检测与预防方案。采用合适胶黏剂、键合工艺或机械夹具的精密密封可保障装置完整性,尤其在多层或共培养芯片中空间隔离至关重要。良好密封还能避免空气进入,从而有助于无菌操作并减少气泡形成。
!微流控芯片使用提示:
使用商用芯片或流通池时,应校准系统参数,并充分考虑材料的光学、化学与物理特性。例如,PDMS会吸附小分子疏水物,影响给药精度;而基于水凝胶的芯片可能存在膜渗漏或形变问题,在灌流前就会影响无菌与密封性
避免气泡以保证均匀流动
气泡会干扰连续流。在三维细胞培养中可造成细胞损伤;在分析中会破坏流场均一性。
- 温度稳定:温度波动会促使溶解气体成核形成气泡;例如升高数摄氏度即可显著降低气体溶解度,从而诱发起泡[10]。
- 防泡策略包括:使用前对培养基脱气;在系统中加入捕泡器或在线脱气膜,拦截并清除可能影响灌流的气泡;在芯片层面集成捕泡/脱气结构,可在气泡到达敏感培养区域前将其物理去除。

图2 微流道内气泡成核的热成像
为流量控制选择合适的灌流泵
泵的与控制方式的选择取决于明确的技术指标。常见用于微流控灌流的设备包括:
- 压力驱动泵可提供精确、可编程且响应迅速的微流体控制,适合要求稳定、低脉冲的敏感应用;其稳定性有助于维持层流,对复现体内剪切应力尤为关键。
- 注射泵可实现恒流(典型精度约0.25%),但更换/补装注射器会中断流动并引入流量脉冲,可能影响敏感细胞或反应。
- 蠕动泵虽易用,但先天产生脉动流,可能对细胞造成应激并增加定量实验的复杂性,对细胞存活率影响显著。
除选择合适的灌流技术外,定期校准与清洁同样重要。例如,生物膜沉积在流量传感器上会引起流量漂移;即便是很小的流速偏差,也会显著改变剪切力与细胞响应,从而影响数据可靠性。
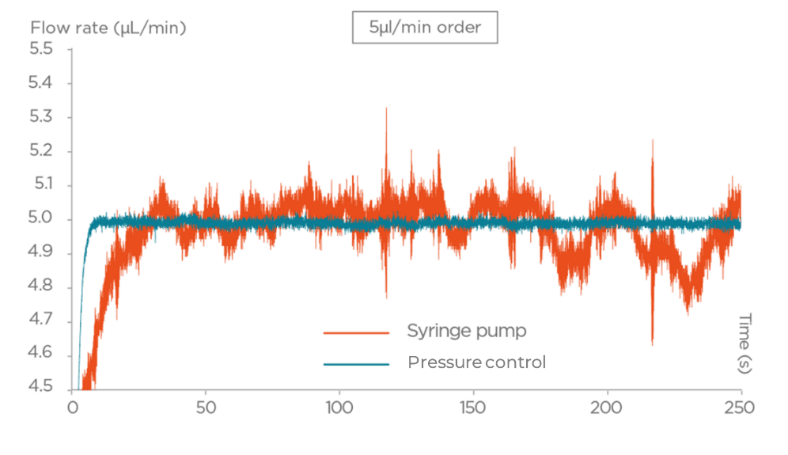
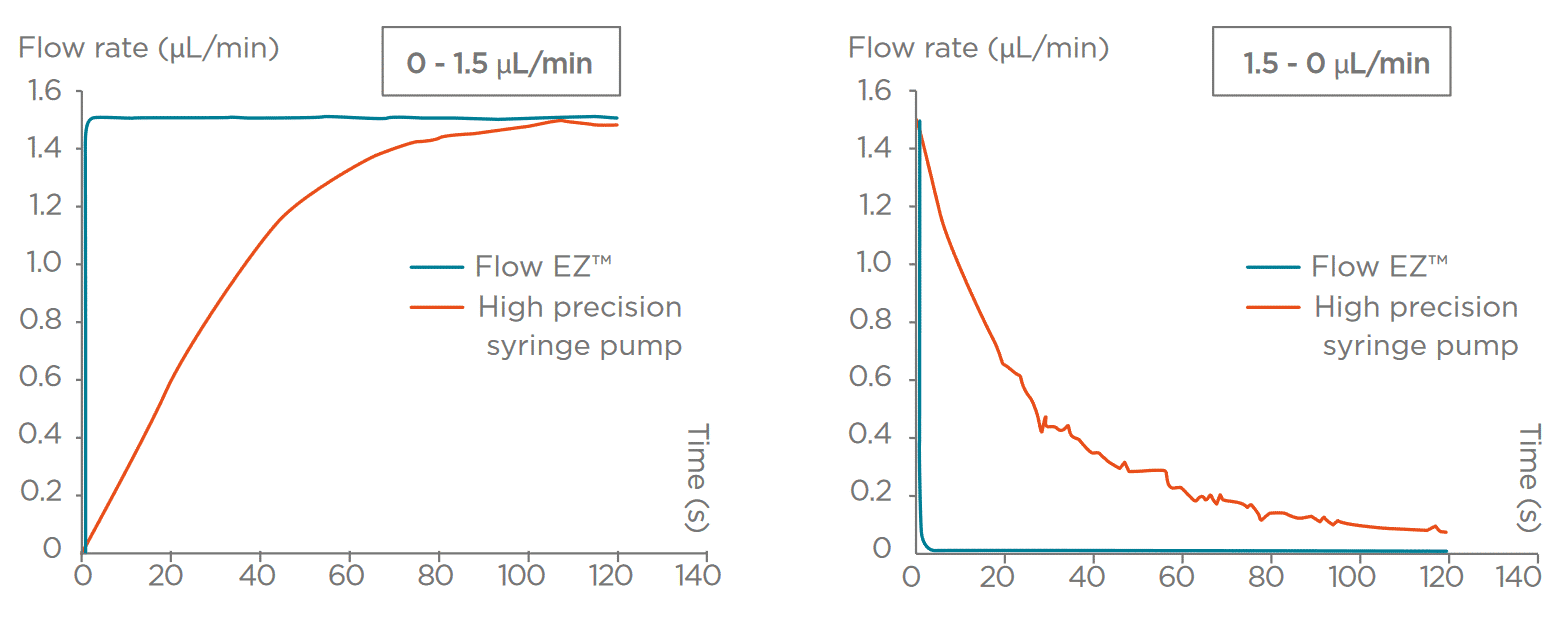
图3 压力泵与注射泵的性能对比
微流控连续流的创新
自动化多路复用系统
用于微流控多路复用的创新方法,旨在精确管理多种输入与试剂,并保障并行通道中的稳定分配。在可控多端口的压力驱动系统中,通过定制歧管可以实现试剂的并行输送与培养基的循环回路。
为实现最多10种试剂的序贯输送,可使用Aria对芯片进行多试剂灌流,其配套软件支持自动试剂注入。
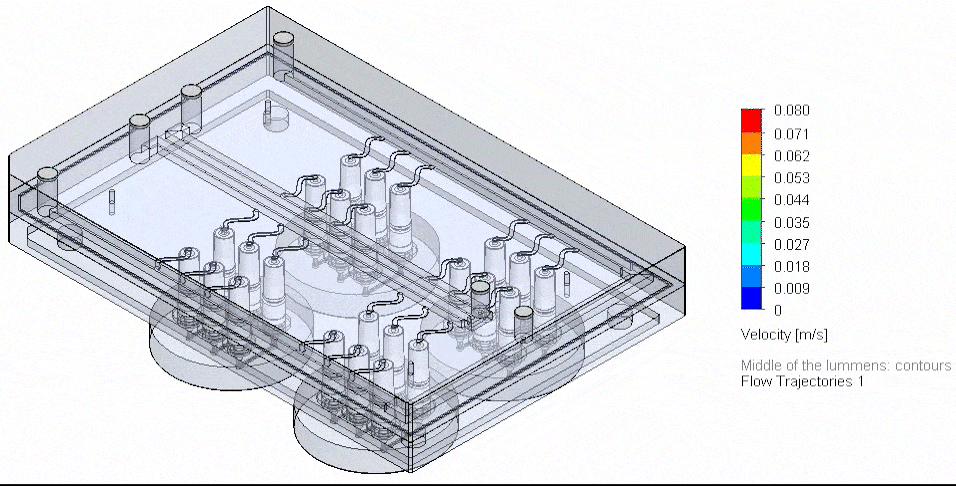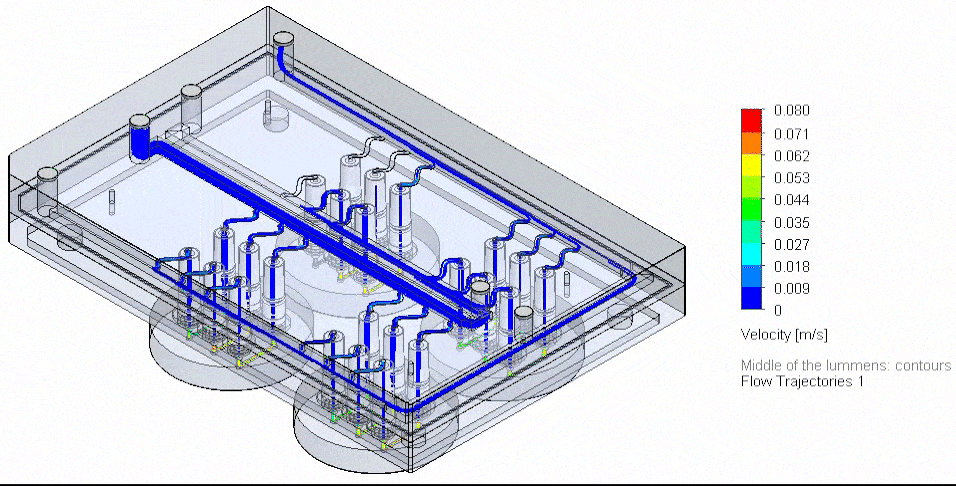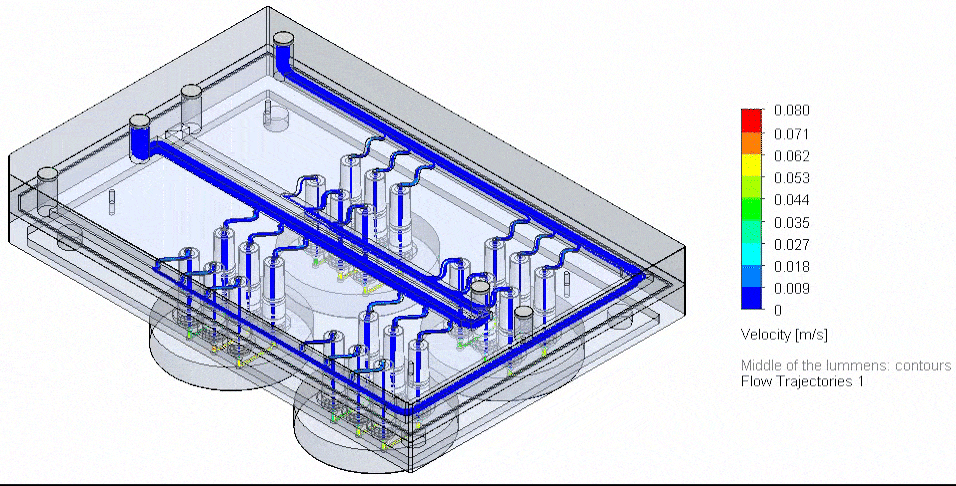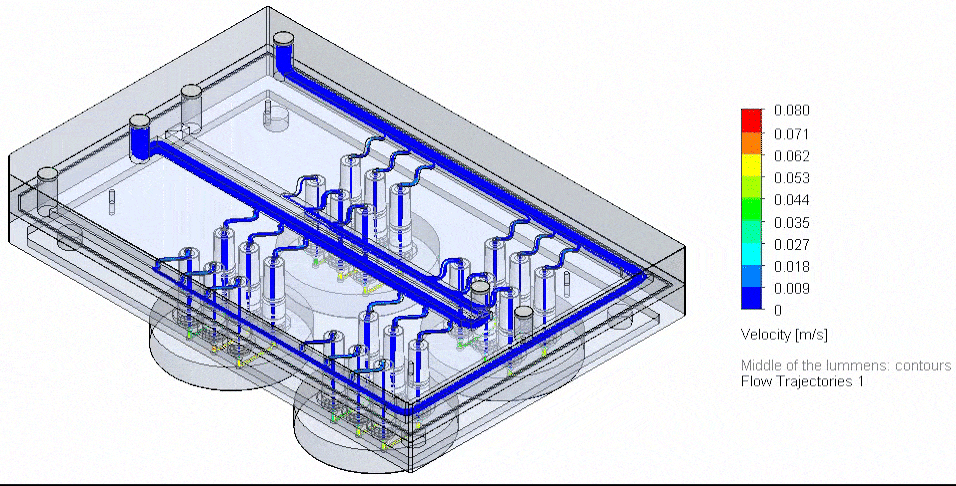
图4 基于3D-VoC模型的流路板自动化示意
集成式实时传感
芯片内或在线传感器(光学/电化学探头或用于炎症标志物的生物传感器等)正用于分析与测量实验结果。闭环控制使传感器能够实时监测培养环境,并据此自动调节灌流参数,确保稳定的生理条件,有利于细胞健康与结果重现性。举例来说,有研究开发了嵌入式微流控光学传感阵列,用于监测流动培养基中的pH与溶解氧,从而在灌流过程中动态校正至设定点[11]。
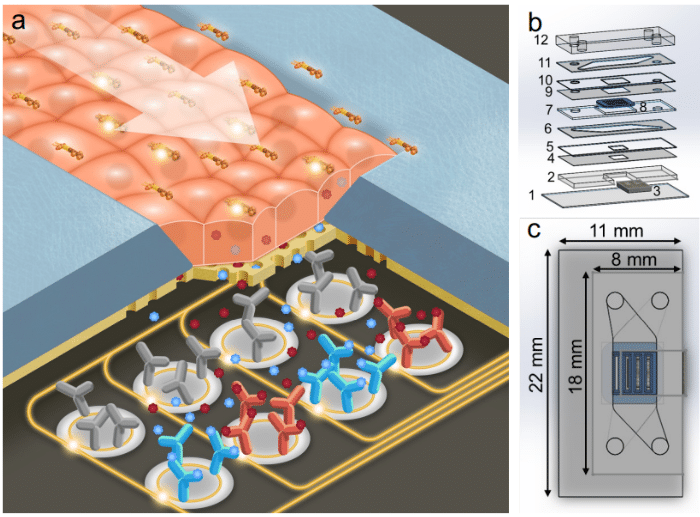
图5 光子传感器集成组织芯片(a. 工作原理示意;b. 分层爆炸图;c. 顶视与外形尺寸)
器官芯片培养基灌流
随着器官芯片的普及,相关技术不断适配以满足不同模型的生理需求。闭环循环灌流带来诸多益处:保障无菌、支持长期循环、降低试剂成本,并可富集目标分泌组分。
连续微流控灌流系统——如Fluigent的Omi平台——通过精确、可编程的流控来复现组织特异性环境,维持屏障完整性、组织结构与长期活性;可支持重复给药和长期培养,提升药筛的预测能力。TissUse的压力装置则用于其自研器官芯片的流体操控。

图6 明场显微镜下的Omi系统
微流控灌流的发展趋势
微流控灌流正从单体系统走向高度集成、智能化与可扩展的平台。展望未来,以下趋势将推动行业变革:
- 复杂多器官集成与闭环系统:“多器官体芯片”生态将兴起:通过互联的组织芯片网络模拟全身生理互作;并可能结合无管路歧管接口,以降低泄漏和起泡风险。
- 新材料与增材制造:智能聚合物与3D打印的进步将支持更复杂的定制几何结构,覆盖更广的生物力学模拟与流体控制场景。
- 监管推进与标准化:]随着灌流微生理系统(如器官芯片)获得监管认可,标准化平台将进入药物研发流程。美国《FDA现代化法案2.0》纳入器官芯片的使用,为其研究成果向临床转化铺平了道路。
仍需解决若干挑战:持续创新的重点方向:
- 气泡形成与流动稳定性:气泡成核问题仍然突出;需要更高效的脱气技术与实时气泡检测。
- 长期无菌与系统鲁棒性:长周期实验需要封闭体系、有效过滤、可靠密封与冗余设计,以防微生物污染。
- 制造放大与成本:从实验室原型走向商业化,需要耐用、易用且性价比高的系统——可通过模块化与可重构单元来实现。
未来愿景:随着上述趋势与解决方案的融合,微流控灌流系统将演进为智能、可靠、易获取的工具;其应用将从专业实验室扩展至主流生物医学研究、药物开发与个性化医疗,推动体外模型迈入更动态、更贴近生理的新阶段。
Related Solutions
References
- Horowitz LF, Rodriguez AD, Ray T, et al. Microfluidics for interrogating live intact tissues. Microsystems & Nanoengineering. 2020;6:69. doi:10.1038/s41378-020-0164-0 nature.com
- Hattori K, Sugiura S, Kanamori T. Pressure-driven microfluidic perfusion culture device for integrated dose-response assays. J Lab Autom. 2013 Dec;18(6):437–45. doi:10.1177/2211068213503155 pubmed.ncbi.nlm.nih.gov
- Sønstevold L, Koza P, Czerkies M, Andreassen E, McMahon P, Vereshchagina E, et al. Prototyping in polymethylpentene to enable oxygen-permeable on-a-chip cell culture and organ-on-a-chip devices suitable for microscopy. Micromachines. 2024;15(7):898. doi:10.3390/mi15070898 doi.org
- Nie J, Fu J, He Y. Hydrogels: The next generation body materials for microfluidic chips? Small. 2020 Nov;16(46):e2003797. doi:10.1002/smll.202003797 pubmed.ncbi.nlm.nih.gov
- Rho JY, Ashman RB, Turner CH. Young’s modulus of trabecular and cortical bone material: ultrasonic and microtensile measurements. J Biomech. 1993;26(2):111–19. doi:10.1016/0021-9290(93)90042-D researchgate.net
- Budday S, Nay R, de Rooij R, Steinmann P, Wyrobek T, Ovaert TC, et al. Mechanical properties of gray and white matter brain tissue by indentation. J Mech Behav Biomed Mater. 2015;46:318–30. doi:10.1016/j.jmbbm.2015.02.024 pubmed.ncbi.nlm.nih.gov
- Choi Y, Tran H-V, Lee TR. Self-assembled monolayer coatings on gold and silica surfaces for antifouling applications: a review. Coatings. 2022;12(10):1462. doi:10.3390/coatings12101462 mdpi.com
- Sun B, Xie K, Chen T-H, Lam RHW. Preferred cell alignment along concave microgrooves. RSC Adv. 2017;7:6788–94. doi:10.1039/c6ra26545f pubs.rsc.org
- Huber D, Oskooei A, Casadevall i Solvas X, de Mello AJ, Kaigala GV. Hydrodynamics in cell studies. Chem Rev. 2018;118(4):2042–79. doi:10.1021/acs.chemrev.7b00317 pubmed.ncbi.nlm.nih.gov
- Pereiro I, Fomitcheva Khartchenko AF, Petrini L, Kaigala GV. Nip the bubble in the bud: a guide to avoid gas nucleation in microfluidics. Lab Chip. 2019;19(14):2296–2314. doi:10.1039/c9lc00211a pubs.rsc.org
- Azimzadeh M, Khashayar P, Amereh M, Tasnim N, Hoorfar M, Akbari M. Microfluidic-based oxygen (O₂) sensors for on-chip monitoring of cell, tissue and organ metabolism. Biosensors. 2021 Dec 22;12(1):6. doi:10.3390/bios12010006 pmc.ncbi.nlm.nih.gov