目录:
微流控与传统药物递送方法的比较?
传统的药物递送方式(口服、注射、吸入等)在提升药物溶解性、稳定性和靶向性的同时,往往面临复杂、可扩展性差、精准度和可重复性不足的制备工艺,加之生物分布不良及生物屏障限制,从而降低了许多治疗剂的疗效。[3]
微流控技术为更高效、可控的递送系统提供了新的方向,能够在微尺度精准、可扩展且可重复地制备先进药物载体(图1)。 [4-6]
本综述总结了微流控在精准药物递送领域的最新进展,按照以下三大主题展开:
(a) 通过微流控平台制备药物载体,包括脂质和聚合物纳米颗粒;
(b) 微流控技术与微针技术的结合,用于微创给药;
(c) 微流控在纳米医学和药物研究中的更广泛应用,如晶体化技术以及体外药物递送机制研究平台的开发。
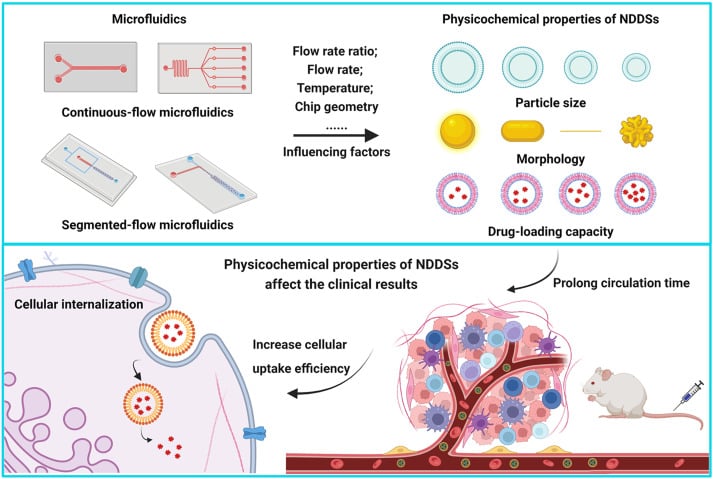
(引自 Zhang, H. 等,Acta Pharmaceutica Sinica B 2023, 13 (8), 3277–3299)。
微流控技术如何改进药物递送颗粒的合成?
1- 脂质纳米颗粒(LNP)微流控合成技术:
脂质纳米颗粒是一类很有前景的药物递送系统,具有良好的生物相容性,能够封装多种治疗分子,并实现可控释放。以下列举了用于 LNP 合成的几种微流控技术 [7]:
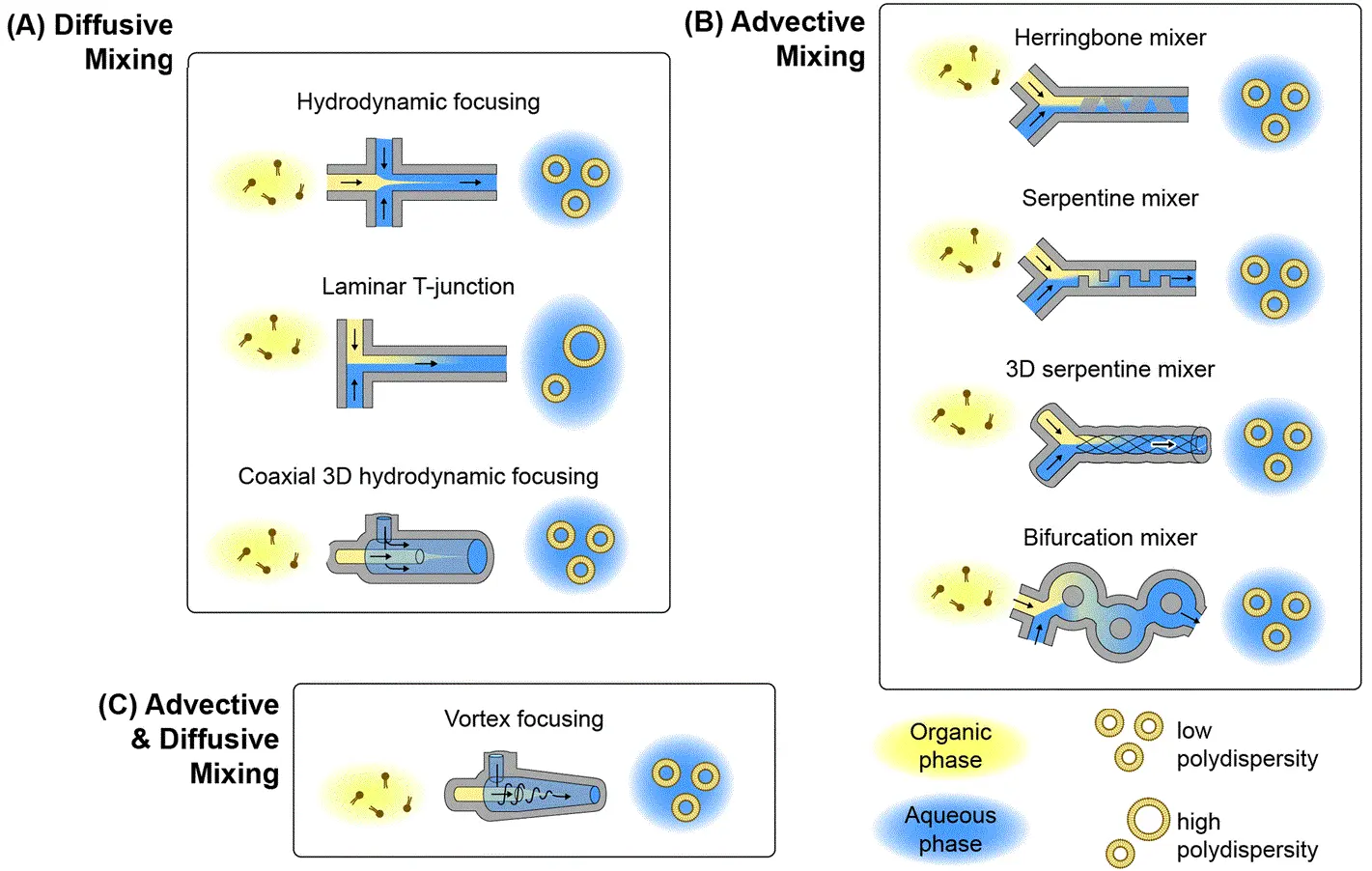
- 微流体水动力聚焦(MHF):
该技术以溶解脂质的有机相为中心流,两侧以水相缓冲液夹持。当脂质流被压缩成薄股后迅速扩散,自组装形成纳米颗粒(见图2‑A)。通过调节各流速比,可精确控制颗粒性质;同时通过调节流道配置,可实现亲水性药物的同步包封。 [8-9 ]
- 混沌对流混合器:
此类装置在微通道中加入锯齿或弯曲等结构,通过拉伸和折叠流体层打破层流,实现快速高效混合(见图2‑B),从而获得更均一的纳米颗粒。该方法兼具快速混合和连续流操作的优势。 [10-12]
- 涡旋聚焦:
该方法结合了 MHF 和混沌混合的特点,在锥形腔中自轴向注入脂质溶液、切向注入缓冲液(见图2‑C),旋涡流同时实现流体聚焦与旋转混合,一步生成纳米颗粒。[13-14]
2- 聚合物纳米颗粒(PNP)的微流控合成:
聚合物纳米颗粒在药物递送中应用广泛,可封装从亲水到疏水、从核酸到蛋白的多种药物。与以脂质为主的自组装结构不同,PNP 由可生物降解或生物相容的聚合物(如 PLGA、PCL 等)组成,可形成矩阵型纳米球或核‑壳纳米囊,赋予更大的封装灵活性。
PNP 的微流控合成在颗粒尺寸、分布以及包封效率的精准控制方面与 LNP 的制备类似(见图3)。两者常用的技术包括水动力聚焦、纳米沉淀和同轴流系统,主要区别在于材料组成和溶剂体系。 [2,5,9,15,16 ]
3- 基于微流控的液滴微粒生产:
由生物高分子制成的微粒正成为可持续药物递送、细胞治疗和生物医用植入物的重要平台。传统批量生产往往粒径分布宽、重复性差,而微流控可以精确调控微粒特性,获得高质量的递送体系。
该技术在微通道内产生液滴,将聚合物溶液包裹于不相混溶的载液中,然后通过交联、溶剂蒸发或聚合等方式固化。通过调节通道几何和流速,可精确控制液滴尺寸和生成频率。
这些方法兼具精度、可重复性,并可兼容多种药物和材料,是下一代治疗体系的理想选择。
表1:微流控药物包封实例(改编自 Parra Saldivar 等,Front Biosci 2018, 10 (1), 74–91)。
| 使用材料 | 几何结构 | 载体材料 | 药物 | 应用 | 参考文献 |
|---|---|---|---|---|---|
| 璃 | 共流 | 人血清白蛋白、聚乳酸 | 多柔比星 | 肝癌 | 20 |
| PEEK 与二氧化硅管 | T 型连接 | 聚甲基丙烯酸酯、聚丙烯酰胺 | 洛芬、雷尼替丁 | 抑制胃部刺激作用 | 21 |
| 硅 | 流体聚焦 | 聚乳酸-羟基乙酸共聚物 | 环孢素 | 免疫抑制治疗 | 22 |
| 聚二甲基硅氧烷 | 带鱼骨纹路的共流 | 脂质体 | 丙泊酚 | 麻醉剂 | 23 |
| 石英芯片 | 流体聚焦 | 透明质酸、乙二胺 | 地塞米松 | 间充质干细胞分化 | 24 |
| 玻璃 | 共流与流体聚焦 | 聚己内酯、聚乙烯醇、聚乙二醇 | 牛血清白蛋白 | 蛋白质治疗 | 25 |
| 聚二甲基硅氧烷 | T 型连接 | 聚乙二醇二丙烯酸酯 | 5-氟尿嘧啶 | 癌症治疗 | 26 |
| 聚甲基丙烯酸甲酯 | V 型连接 | 聚甲基硅氧烷 | 伊曲康唑 | 抗真菌感染药 | 27 |
基于微流控的无载体微针药物递送系统
微流控技术推动了无载体药物递送系统的发展。借助微流控平台的精准与可控性,药物可直接输送至靶位,减少传统载体的需求,从而提高生物利用度并实现精准释放。微针是该体系中最有前景的部件之一,常与微流控设备深度集成,以优化治疗分子的递送。
微针(MNs):微针由一系列微尺度针体组成,可穿透皮肤或其他组织,进行靶向给药;其微创且几乎无痛,可替代传统注射或口服给药。微流控提供的流量控制确保药物在局部精准释放,特别适用于在消化系统中易降解的药物。
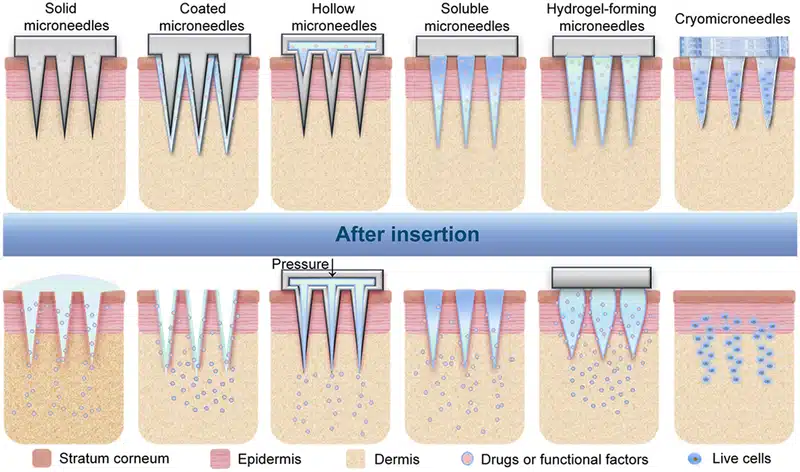
微针的类型:
- 实心微针:通过在皮肤上打孔后再涂布药物,使药物被动扩散进入皮肤。常用材料包括硅、金属和聚合物。
- 可溶解微针:由可降解材料制成,插入皮肤后自行溶解,将药物直接释放到目标组织。常用材料包括聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP)、聚乳酸(PLA)等。[31]
- 水凝胶微针:由可吸水膨胀的聚合物制成,插入皮肤后通过水凝胶的膨胀释放药物。常用材料包括聚乙二醇(PEG)、聚丙烯酰胺(PAAm)、壳聚糖等。
- 空心微针:针体中空,可直接将药物注入体内。常用材料包括玻璃、硅、金属和聚合物。
用于药物递送评估的体外模型
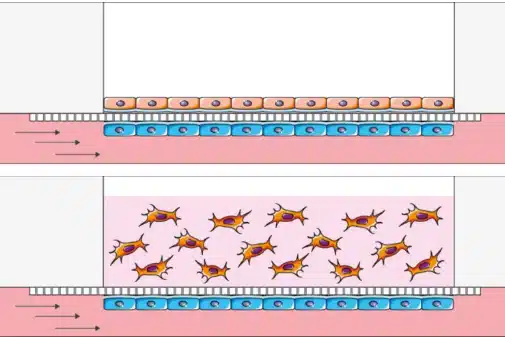
为了弥合传统体外模型与人体生理复杂性之间的差距,器官芯片(OOC)平台作为强有力工具被用于评估药物递送系统。这些模型在动态结构与功能上高度仿真人体组织,可提供药物运输、吸收及治疗反应的洞见。
药物载体进入体内后,通往靶位的过程中会受到多种生理屏障阻碍。准确地模拟并理解这些障碍对于开发安全有效的递送系统至关重要。微流控 OOC 平台提供了一个可控环境,可实时模拟和分析这些屏障。
主要生理屏障包括:
- 血脑屏障(BBB):这一高度调控的界面限制了大多数治疗剂进入大脑。微流控 BBB‑on‑a‑chip 通过在剪切流条件下共培养内皮细胞、星形胶质细胞和周细胞,模拟 BBB 的选择性通透性和紧密连接,对于评估脑靶向药物递送极为重要。 [37]
- 黏膜扩散屏障:存在于胃肠道、呼吸道及生殖道等部位,由致密的黏液层组成,可捕获并排除外来颗粒。微流控模型可复现黏液粘度与分泌动力学,实时观察纳米颗粒扩散、穿透和滞留情况,适用于口服和肺部给药研究。 [38]
- 细胞通透屏障:由具紧密连接的上皮或内皮单层构成,控制跨细胞和旁细胞转运。芯片系统可模拟细胞结构与机械刺激,用于研究纳米颗粒摄取、受体介导运输及屏障完整性调控。
- 生化屏障:体内酶与 pH 变化(尤其在胃肠道及溶酶体环境)可使药物在到达靶位前降解或失活。微流控生化模型通过模拟这些条件,测试纳米载体在生理相关压力下的稳定性和保护效能。
将上述屏障整合到微流控器官芯片中,可实现更具预测性且更符合人源的临床前评价。
诸如肠芯片、血管芯片、血脑屏障芯片等芯片已展示了微流控精准药物递送的潜力。
随着微流控药物递送领域的不断发展,这些平台可用于纳米医学中的药代动力学、药效学及治疗指数评估,降低对动物模型的依赖。
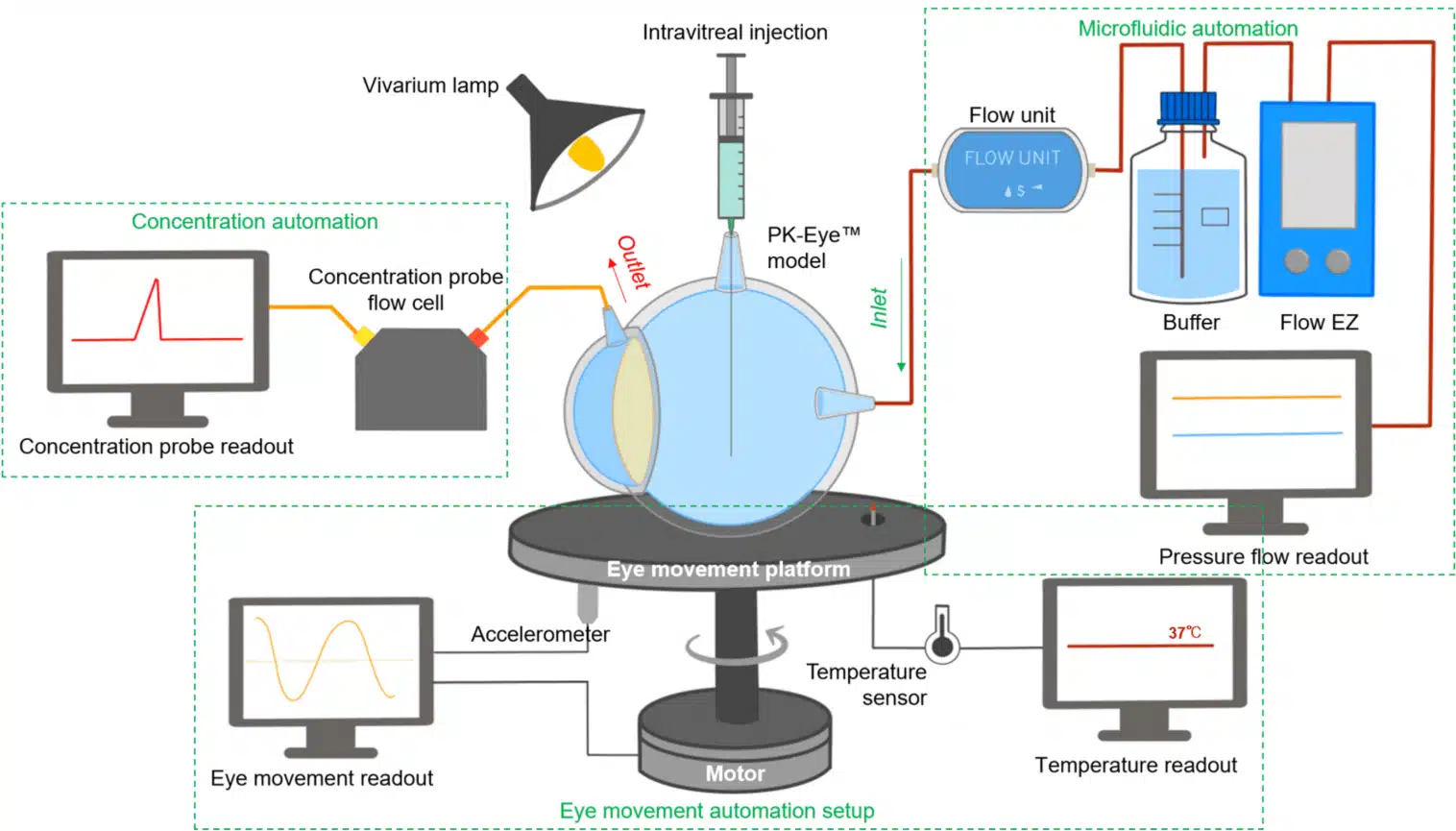
在眼部给药的案例中,利用微流控系统复制动态的眼内环境,通过集成流量控制和温度调节,可模拟眼内压力波动与眼球运动,精确评估这些变量对药物清除与滞留的影响。多模型自动化传感与同步流体管理提高了重现性和通量,为眼科药物递送的配方筛选提供了更具预测性和可扩展性的测试方法。 [40]
微流控在药物及蛋白质晶体化研究中的应用
微流控系统也在改变蛋白质晶体化这一药物开发关键步骤。传统方法需要大量样品,而微流控平台仅需极少量蛋白和试剂即可筛选晶体化条件,通过模拟不同 pH、温度和盐浓度,加速并提高晶体化效率。
最新创新(如基于离心的微流控装置和半接触式分液技术)提升了高通量筛选与精度,降低成本并加速药物开发,为结构分析提供高质量蛋白晶体,从而促进更精准的药物递送。
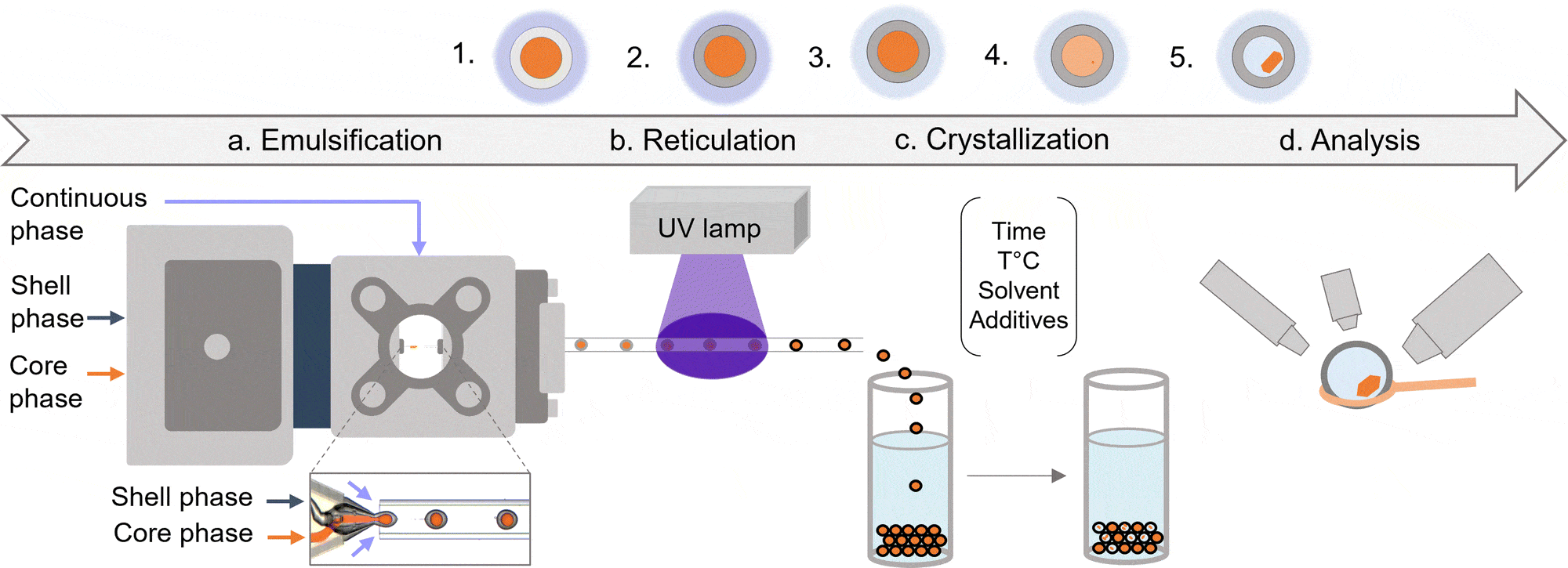

图8:(左)晶体化过程示意图示例;(右)微胶囊中的溶菌酶晶体(引自 Mettler, M. 等,Chem. Commun. 59, 12739–12742 (2023))。
结论
本综述回顾了微流控技术在药物递送系统中的最新进展,可提升生物利用度、药效及纳米颗粒性能。尽管已取得进展,将这些系统扩大到临床应用仍面临挑战,需要改进并行化和简化制备工艺。将微流控与器官芯片结合,为更准确的临床前测试和个性化医疗提供了有力方案。随着跨学科合作的持续深入,微流控有望进一步改变药物递送与治疗应用。
👉 准备好改进您的药物递送流程了吗?欢迎联系专家或探索我们的微流控压力控制系统。
